De nuevo continuando la serie de artículos sobre las «nuevas estrategias en la nutrición deportiva para aumentar el rendimiento deportivo» que como dije constará en varias partes. Aconsejo que quien no haya leído la 1º parte, la lea antes de leer esta ultima, ya que esta hace referencia a cierto contenido de la primera. A continuación me centraré en la adaptación de los planes nutricionales bajos en grasa (ceto-adaptación) en el papel de las grasas como sustrato energético, en su oxidación, y su impacto en el rendimiento físico.
2.5. Adaptación sobre las dietas ricas en grasas y su rendimiento en el ejercicio
Los atletas de resistencia desarrollan una alta capacidad para alimentar (suministrar energía) el ejercicio a través de la oxidación de las grasas como una adaptación a su entrenamiento. Sin embargo, ha habido focos de interés en las estrategias que pueden aumentar aún más la regulación de la contribución de la grasa como sustrato energético para el ejercicio; Específicamente, el consumo crónico de una dieta baja en carbohidratos, alta en grasas (LCHF). Los modelos más usados han incluido una restricción de carbohidratos moderada (<20% de la energía) a extrema (<50 g / d), con grasa aumentando a ~ 65% o ~ 80% respectivamente [73]. Han reportado beneficios en el rendimiento deportivo a través de una mayor utilización de las reservas de grasa corporal, en umbrales de utilización relativamente grandes, así como otros efectos propios de la adaptación crónica a altos niveles de cetonas circulantes es decir, una («ceto-adaptación«) [74]. Dejar claro que, tales regímenes, no deben confundirse con otras dietas populares de alto contenido proteico, y CHO reducidos, tales como la «dieta Paleo» las cuales no tienen nada de relación con las que comento.
El interés original en el LCHF para el rendimiento deportivo se derivó de un estudio de 1983 que midió la capacidad de ejercicio en 5 ciclistas bien entrenados antes y después de 4 semanas de una dieta cetogénica LCHF [75]. A pesar de las condiciones que debieron haber favorecido un beneficio para la resistencia (4 semanas adicionales de entrenamiento, ayuno nocturno y agua solamente durante el ciclismo, cargas de trabajo de intensidad muy moderada ~ 60% VO2máx), no hubo mejoría significativa en el tiempo de agotamiento sobre los valores basales completados con una dieta alta en carbohidratos. Por otra parte, los resultados fueron sesgados por un gran aumento en la resistencia, y los autores también observaron que la mayor utilización de la grasa y el ahorro de carbohidratos a moderada intensidad era «una limitación de la intensidad del ejercicio» y un «ahogo de la función cerca del VO2max» [75].

Durante el período de 1995 a 2005, los investigadores de una serie de laboratorios examinaron el efecto de las dietas no cetogénicas de LCHF en el ejercicio / rendimiento deportivo [73]. Los resultados confirmaron la falta de un efecto claro sobre el rendimiento a pesar de los marcados cambios en la capacidad de utilizar la grasa, pero identificaron algunos escenarios, como el ejercicio submáximo realizado con las reservas de glucógeno muscular agotado, en el que se podrían observar algunos beneficios. El hallazgo de que los cambios en la utilización del sustrato durante el ejercicio ocurrieron en tan sólo 5 días de adaptación a la LCHF la cual allanó el camino para una nueva serie de estudios en los que los atletas emprendieron tal adaptación de grasa y restauraron la disponibilidad de carbohidratos justo antes y durante con la intención de promover el rendimiento a través de cierta suministración optimizada de la grasa y las vías de carbohidratos [73]. En este caso, debe tenerse en cuenta que un cambio en las mediciones de la relación de intercambio respiratorio durante el ejercicio, que se utilizan a menudo para marcar cambios en la utilización del sustrato, puede reflejar la disponibilidad predominante de dicho sustrato en lugar de una verdadera adaptación en el músculo. Sin embargo, varios estudios confirmaron que la exposición a la dieta LCHF logró una alteración robusta a los factores reguladores en la utilización de la grasa; Los cambios incluyen un aumento de las reservas de triglicéridos musculares, una mayor actividad de la lipasa sensible a las hormonas, que moviliza los triglicéridos en el músculo y el tejido adiposo y aumenta las moléculas clave de transporte de grasas como la translocasa de ácidos grasos y la Carnitina Palmitoyl Transferasa (CPT ) [76]. Además, el aumento en la utilización de grasa durante el ejercicio persistió cuando los suministros de hidratos de carbono estaban en toda su esencia. Sin embargo, de nuevo, estas investigaciones no encontraron evidencia 100% CLARAS de beneficios en el rendimiento, pero si descubrieron mecanismos para explicar cambios metabólicos en el músculo, así como información sobre escenarios en los que la adaptación de grasa podría ser benigna y aquellos en los que perjudicarian el rendimiento deportivo [73].
Un estudio histórico investigó el efecto de la adaptación de grasas y la restauración de carbohidratos en una simulación real de rendimiento deportivo que implicó la finalización de un ensayo de 100 km en ciclismo durante el cual se les requirió a los sujetos que completasen «sprints» a intensidades> 90% de pico de potencia [77]. Aunque el resultado global fue un beneficio (no significativo) de ~ 3 min en el ensayo control, el resultado sorprendente fue la observación de que la capacidad del ciclista para sprintar a intensidades más altas se deterioró después de la estrategia de adaptación de la grasa. Una investigación separada que se realizó al mismo tiempo proporcionó la explicación mecanicista unificadora de toda la literatura anterior: he aqui el kit de la cuestión lectores/as, la ingesta crónica de la dieta LCHF afecta negativamente de manera específica, ya que reduce la utilización de glucógeno muscular durante el ejercicio, «gracias» a que reduce la glucogenolisis y a su vez disminuye la forma activa de piruvato deshidrogenasa (PDHa) regulador de la entrada de carbohidratos en el ciclo del ácido cítrico [78]. Este hallazgo suscitó la opinión de que el LCHF tenía poco papel que desempeñar en la preparación de atletas competitivos, ya que probablemente perjudicaría su capacidad para el ejercicio de alta intensidad que es un requisito previo para el éxito en la mayoría de los deportes de competición 79.
Recientemente ha surgido un renovado y ferviente interés por la versión cetogénica de la LCHF, apoyada por las reivindicaciones teóricas para la salud y el rendimiento deportivo [74], pero ampliamente promovido por el fenómeno de las redes sociales. Si bien esto merece un examen más detenido, es difícil hacer conclusiones diferentes en ausencia de nuevos datos. Sin embargo, se ha observado una frustración ya que existe una inexactitud inexplicable de las directrices actuales de la nutrición deportiva por los proponentes del movimiento de las dietas LCHF [73]. En lugar de promover «dietas altas en carbohidratos para todos los atletas», tanto las directrices como las prácticas de los nutricionistas deportivos contemporáneos se han alejado de un mensaje tan universal. En su lugar, promueven un enfoque individualizado y periodizado para evitar la ingesta innecesaria y excesiva de hidratos de carbono per se, para optimizar los resultados del entrenamiento a través de la modificación del tiempo, cantidad y tipo de alimentos ricos en carbohidratos y bebidas para equilibrar los períodos de baja y alta disponibilidad de carbohidratos y adoptar estrategias de competencia bien practicadas que proporcionen la disponibilidad apropiada de carbohidratos de acuerdo con las necesidades y oportunidades proporcionadas por el evento y la experiencia individual [73] [ver Sección 2.2 parte 1]. Se necesitan más investigaciones para seguir desarrollando estos modelos, incluyendo el examen de escenarios en los que la dieta LCHF puede ser beneficiosa o al menos no perjudicial para el rendimiento deportivo.
A continuación voy a escribir sobre la regulación molecular que se produce tras un entrenamiento de la fuerza (entrenamiento resistido) de la cual he hablado en numerosas ocasiones en mi web, pero aun así voy a hacer un breve repaso, ya que es necesaria tenerla en cuenta para entender bien toda la entrada.
2.6. La regulación molecular de la adaptación al entrenamiento de Fuerza
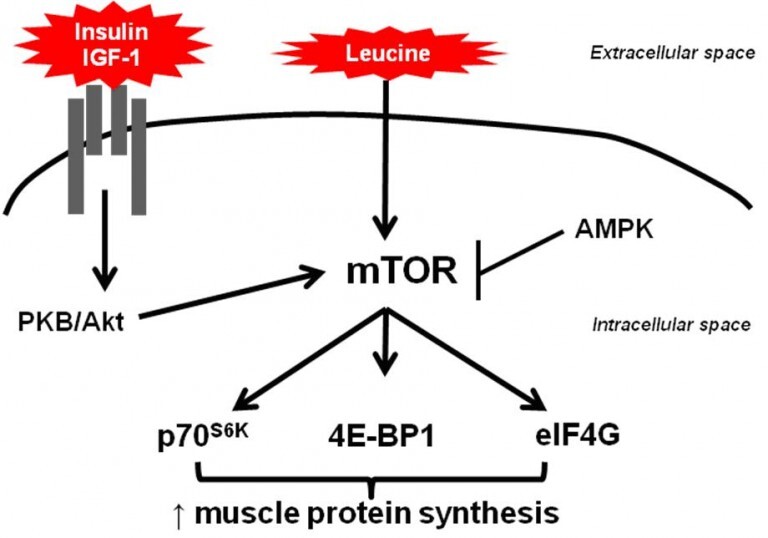
El entrenamiento de resistencia se define típicamente como realizar contracciones de intensidad relativamente alta contra una carga externa durante un período de tiempo relativamente corto [5]. El ejercicio de resistencia se realiza generalmente utilizando cargas externas y se utiliza como complemento de todos los deportes, o como para la realización del mismo deporte específico como por ejemplo el levantamiento de pesas olímpico.. En otros deportes como por ejemplo el rugby, el entrenamiento de fuerza se utiliza para agregar o mantener el peso funcional del atleta y mejorar la potencia en las tareas específicas del deporte es cuestión. Un programa de entrenamiento de resistencia debidamente estructurado conducirá a la mejora de la fuerza en parte a través de mejoras en la masa muscular [80]. La fuerza de un individuo es altamente, pero no totalmente dependiente de la masa muscular [81] y [82]. El ejercicio de resistencia construye la masa muscular aumentando la remodelación de las proteínas musculares y sensibilizando la maquinaria de síntesis de proteínas del músculo esquelético a las comidas subsiguientes [83]. Al igual que con el ejercicio de resistencia, la nutrición puede jugar un papel crítico en el aumento del estímulo adaptativo que proviene de ejercicio de resistencia [84]. Aunque las adaptaciones al ejercicio de resistencia se cree que son impulsadas principalmente por las respuestas transcripcionales [2] y [8], el crecimiento muscular de adaptación al ejercicio de resistencia es impulsado principalmente por los cambios en la traslación, en particular por los aumentos de la actividad de ARNm (proteína producida por unidad de mRNA ) [85], [86] y [87]. El complejo de rapamicina 1 (mTORC1) es un controlador clave de la síntesis de proteínas a través del control que ejerce sobre la actividad del ARNm a través de la iniciación del traslado proteíco [88] (Fig. 2).
Las vías mecánicamente sensibles que responden a la carga a través del músculo para aumentar MPS (síntesis de proteínas) convergen con aquellos que responden a aumentos en las concentraciones intracelulares de aminoácidos y/o insulina en la mTORC1 [88] (Fig. 2). La MTORC1 está bien definida en la literatura y evidencia científica como esencial para el crecimiento muscular [89] y el estímulo inducido por los aumentos en la MPS [90] y [91]. Pues la activación de la mTORC1 se requiere para los aumentos en la síntesis de proteínas impulsados por los aminoácidos [90] y el ejercicio de fuerza [91]. En consecuencia, de esto último, cuando la actividad de la mTORC1 [89] o la actividad descendente p70S6K1 están alteradas, la masa muscular se ve afectada y con ello la fuerza. Por lo tanto, es lógico suponer que los aumentos en la síntesis de proteínas musculares podrían ser mejorados mediante la mejora de la activación de mTORC1. Esto se puede lograr nutricionalmente de varias maneras:
- Con proteínas de alta calidad o aminoácidos esenciales
- Con hidratos de carbono impulsando el aumento de la insulina.
La actividad del componente catalítico de mTORC1, mTOR, contra sus sustratos depende en gran medida de la formación del complejo mTOR. Este complejo se compone de una serie de proteínas diferentes, mTOR, GbetaL, raptor, etcétera además de una asociación aparente necesaria con las membranas lisosomales [94]. Tambien tenemos que tener en cuenta que la mTORC1 tiene una serie de represores, que deben ser disociados del complejo para permitir que se active, como PRAS40 y DEPTOR [94]. Finalmente, la kinasa lipídica sensible al aminoácido hVPS34 también desempeña un papel clave en la activación de mTORC1 [95] al igual que el miembro de la familia MAPK MAP4K3 [96] (Figura 2). El trabajo basado en células ha demostrado que este sistema de detección de aminoácidos es increíblemente sensible con un aumento del ~ 7% en la leucina intracelular que conduce a la activación máxima del 50% de mTORC1 [97]. Además, sólo una fracción de actividad máxima de la mTORC1 (~ 30%) es necesaria para saturar completamente la síntesis de proteínas musculares [98] [99]. La detección de aminoácidos por mTORC1 también parece ser impulsada no extracelularmente, sino por las concentraciones intracelulares de aminoácidos [100]. Los mecanismos por los cuales esto ocurre son increíblemente complejos y aún no está del todo definidos. Debido a que las vías mecánicas son tremendamente sensibles y las vías de detección de aminoácidos son distintas, el consumo de aminoácidos esenciales después del ejercicio de fuerza activa significativamente la mTORC1 por encima de la práctica de ejercicio de fuerza solamente, es decir, sin esa ingesta de aminoácidos, esto está más que demostrado [103]. Hemos sabido durante varias décadas que el consumo de aminoácidos esenciales en estrecha proximidad (24-72h) al ejercicio de fuerza puede mejorar la respuesta sintética de proteínas en el músculo esquelético y ahora sabemos que al menos unos~ 20 g de proteína de alta calidad es suficiente para saturar la respuesta sintética de la proteína después del ejercicio de fuerza. Además de la literatura y evidencia científica existente, que nos dice que la ingestión de proteínas durante un programa de entrenamiento de fuerza mejora la adherencia al mismo, ademas del considerable aumento de la masa magra / ganancias musculares [84]. En este otro estudio (Kakigi y col, 2014; Eur J Appl Physiol 3-ene) en el que los autores determinaron la respuesta de la mTOR en los músculos implicados en un entrenamiento de fuerza en dependencia a la ingesta de proteínas. Los sujetos realizaron una sesión de entrenamiento de fuerza y al finalizar consumieron agua, 10 ó 20 g de proteínas de suero. Los resultados mostraron que la ingesta de proteínas al finalizar el entrenamiento activó la vía de señalización de la mTOR de manera dosis dependiente, con una mayor activación con la ingesta de 20 g frente a 10 g de proteínas. Sin embargo, tenemos otros estudios que nos dice que más no es mejor, una ingesta de 4 gramos por kilogramo de peso corporal , no mostró mayor activación de la mTOR.
El factor clave para la alimentación de proteínas inducida por aumentos en MPS parece ser el contenido de leucina (uno de los 9 aminoácidos esenciales) de la proteína digerida [107] y, posiblemente, el metabolito de la leucina β-hidroxi β-metilbutirato (si, el famoso HMB) [108]. Ambos activan la mTORC1 en el músculo esquelético humano cuando se consumen [108]. Por lo tanto, parece que los aminoácidos y el ejercicio de fuerza aumentan la MPS a través de un doble efecto en el aumento de la actividad de mTORC1 (Figura 2).
Este estudio se realizó para determinar si una mezcla de proteínas de baja dosis de leucina ingerida después del ejercicio de fuerza aumenta la proteína miofibrilar del músculo esquelético en la tasa sintética fraccional (FSR). Compuesto por doce hombres entrenados, completarón 100 min de ciclismo de alta intensidad, a continuación, se dividierón en 3 grupos:
Formato; proteína/leucina/hidratos de carbono/grasas
Grupo 1º (15LEU): 70/15/180/30 gramos
Grupo 2º (5LEU): 23/5/180/30 gramos
Grupo 3º (CON): 0 / 0/274/30 gramos
Las biopsias musculares se recogierón a los 30 y 240 minutos en la recuperación,
La ingesta de 23 gramos de proteína con 5 gramos de leucina de añadido, maximizó la tasa de FSR tras el ejercicio de fuerza, o lo que es lo mismo (después de ejercicio de fuerza 23g proteína + 5g leucina ocasiono una mayor síntesis proteica muscular) un efecto poco probable de atribuir a la señalización de MTORC1-S6K-rpS6, si no al añadido de leucina. No obstante, el fenómeno leucina en relación a la cantidad como sus efectos sobre la síntesis de proteínas para optimizar la adaptación y el rendimiento deportivo requiere mayor investigación.
Sobre la relación entre la ingesta de proteínas y la síntesis muscular FRS, hay todo tipo de detalles y matices. aunque les puedo resumir que, en mi opinión es una cuestión en la que parece haber bastante variabilidad de una persona a otra y que todavía no nada clara.
Un estudio del Journal of Nutrition, “Dietary Protein Distribution Positively Influences 24-h Muscle Protein Synthesis in Healthy Adults“, en el que investigadores norteamericanos han comparado indicadores de síntesis muscular al seguir dos dietas isocalóricas y con la misma cantidad de proteínas (casi 100 gramos diarios), pero distribuidas de forma diferente. En una de ellas los sujetos tomaron un tercio de proteínas (unos 30 gramos) en cada una de las comidas (desayuno, comida y cena) y en la otra agruparon la mayor parte de las proteínas en la cena (dos tercios) y el resto se repartió entre desayuno y comida.
Pues, bien, los mejores resultados se obtuvieron al seguir la primera opción. Con la distribución de proteínas uniforme, la síntesis muscular FRS fue un 25% mayor.
Este estudio parece decirnos que el consumo de una cantidad moderada de proteína de alta calidad 3 veces al día estimula la síntesis de proteína muscular en mayor medida que la práctica común de sesgar el consumo de proteínas hacia la comida de la noche. Específicamente, la FRS fue un ~ 25% mayor cuando la ingesta de proteína fué distribuida de manera uniforme.
Respecto al ejercicio resistido (fuerza) tenemos que saber que sus efectos residuales por si solos, son potentes y de larga duración, elevando el estado basal de SPM durante al menos 48 h (Phillips et al., 1997). Y como ya dije anteriormente se ha demostrado en numerosas ocasiones que el consumo de proteína inmediatamente después del ejercicio estimula la SPM aún más (Breen & Phillips, 2012; Churchward-Venne et al., 2012). Inclusive hasta 24 h después del ejercicio de fuerza el músculo permanece sensible a los efectos del ejercicio y demuestra un incremento en la respuesta de la SPM al aumentarse los niveles sanguíneos de aminoácidos (Burd et al., 2011). Así que, es razonable pensar que inclusive en momentos posteriores a las 24 h, pareciera haber un aumento en la sensibilidad.
Como podemos ver el ejercicio de fuerza produce un incremento prolongado en la síntesis de proteínas musculares (SPM) que puede permanecer elevada durante ≥ 24 h (líneas punteadas). Por eso se postula que la ingesta de proteínas en cualquier momento durante este período de “potencial anabólico” aumentado será aditivo para estas tasas ya elevadas producidas por el ejercicio (líneas sólidas).
Como ilustra la gráficca“la ventana” para el consumo de proteínas es más larga de lo que apreciábamos anteriormente. No obstante, es posible que existan ventajas al consumir proteínas en momentos cercanos al ejercicio.
Esta figura podemos ver la distribución de proteína , según la cantidad total de proteína en una ingesta (ojo aqui que no dije momento del dia como en el anterior estudio, si no cantidad diaria TOTAL). Para maximizar el potencial de la síntesis proteica en el musculo esquelético, hay que asegurar una cantidad óptima y mínima de proteína. En especial para atletas, que desean conservar o construir su masa muscular, o por ejemplo para pacientes con alto riesgo de sarcopenia, (ancianos en especial) o personas que llevan dietas restrictivas.
Sin embargo, dicho todo esto, no todos los estímulos que activan mTORC1 conducen a una mejor síntesis de proteínas. Como mencionamos anteriormente, los aumentos de insulina en carbohidratos pueden aumentar la actividad de mTORC1. Ya que cuando la insulina se produce a niveles supra-fisiológicos la mTORC1 es activada de manera potente sin un aumento concomitante en la síntesis de proteínas musculares [99]. Por lo tanto, los datos respecto a este tema son claros, la activación de la mTORC1 se requiere para el crecimiento del tejido muscular, que es propiciado por el entrenamiento resistido (fuerza) [89,91] que a su vez es apoyada por la alimentación que finalmente induce la síntesis de proteínas [90], pero aun así; todavía no esta del todo claro si, manipular la mTORC1 por encima de lo que ocurre fisiológicamente, conducirá o nos proporcionará un crecimiento muscular mayor. (leer mas sobre este tema aqui)
2.7 Áreas nuevas y/o inexploradas en la nutrición proteica?
Una pregunta clave en el campo de la nutrición deportiva siempre ha sido «¿cuánta proteína necesito para maximizar el crecimiento muscular?» Varios estudios que estudian esas «unica dosis» a la de proteínas han demostrado que con una pequeña dosis de ~ 20 g de proteína de alta calidad (alimento con un aminograma completo o proteína de suero) y ejercicio de fuerza (entrenamiento unilateral o bilateral) es suficiente para estimular al máximo el SPM [105] y[106]. Estos estudios han recorrido un largo camino para optimizar la nutrición post-ejercicio. Sin embargo, ningún estudio ha evaluado si el aumento de la cantidad de masa muscular trabajada, o el tamaño del individuo, jugara algún papel en las necesidades de proteínas después del ejercicio. Sin embargo, el trabajo de Stu Phillips de laboratorio ha analizado retrospectivamente una serie de estudios sobre la síntesis de proteínas musculares (MPS) en un intento de identificar si las tasas máximas son dependientes de la masa corporal. Este análisis ha sugerido que la dosis óptima de proteína post-ejercicio en hombres jóvenes sanos puede ser mejor cuantificada en base ag / kg o incluso ag / kg de masa magra con ~ 0,25 g / kg de masa corporal y 0,25 g / kg de masa magra para obtener las tasas máximas de MPS [109].
Además de los beneficios de consumir proteínas de alta calidad en la masa muscular y la recuperación del ejercicio, los alimentos ricos en proteína de alta calidad por ende tienden a ser ricos en otros nutrientes. Estos otros nutrientes pueden potencialmente tener beneficios más allá del contenido de proteínas [110]. En particular, las fuentes de proteínas lácteas, debido al alto contenido de calcio se han alabado por esta razón [111]. Además, una serie de estudios han puesto de relieve los beneficios de la ingesta de proteínas a base de leche, en particular el suero[112]. Se cree que este hallazgo se debe al mayor contenido de leucina del suero de leche. Sin embargo, un área que ha sido muy especulado, pero muy poco explicado es la posibilidad de péptidos digeridos de proteínas ingeridas que tienen actividades biológicas beneficiosas [113]. Las proteínas basadas en la leche en particular pueden ser digeridas a través de peptidasas gastrointestinales a péptidos que contienen triptófano, que en ensayos basados en células y bioquímicos pueden tener actividades biológicas que pueden afectar positivamente la fisiología humana desde el control de la presión sanguínea hasta la saciedad. Hay pocos estudios que hablen de la MPS y FRS respecto al tipo de proteína ingerida, este reciente estudio examinaron el impacto de ingerir proteína de vacuno hidrolizada, proteína de suero y carbohidratos, sobre los resultados de un entrenamiento de fuerza, composición corporal, espesor muscular, e indicadores de inmunidad humoral en saliva (α-defensina-salivar, HNP1-3), después de 8 semanas de entrenamiento de fuerza en estudiantes universitarios. Los voluntarios (chicos y chicas) fueron distribuidos aleatoriamente a uno de los siguientes grupos: proteína de vacuno hidrolizada, proteína de suero o carbohidratos. El tratamiento consistió en 20 g de suplementación mezclado con zumo de naranja, una vez al día, inmediatamente después de entrenar o antes de desayunar en los días de no entrenamiento. Se realizaron valoraciones antes y después del periodo de entrenamiento. Los resultados más relevantes del estudio mostraron que la concentración de defensinas en saliva (péptidos de neutrófilos, HNP1-3) y su tasa de secreción, disminuyeron en la condición proteínas de vacuno. Una tendencia no significativa en el mismo sentido se observó en el grupo que ingirió proteínas de suero. Ninguna de las condiciones experimentales afectó a los indicadores de salud sanguíneos evaluados. Sin embargo, se sigue postulando que la calidad de la proteína sigue jugando un papel fundamental en la síntesis de proteínas, aun así, dicha diferenciación sigue siendo muy difícil de detectar. Como dije anteriormente el contenido de leucina de una proteína es el determinante más fuerte respecto a su capacidad para afectar a la MPS y subyacente hipertrofia muscular. Es cierto que hay pocos estudios que realmente han estudiado el DIAAS (rátio del aminograma), lo que debería de cambiar en un futuro, ya que el DIAAS ahora se conoce que es de gran importancia.
Sin embargo, sigue habiendo cierta confusión con la cantidad optima de proteína en una ingesta para mayor estimulación de la MPS. La principal creencia detrás de las grandes cantidades de consumo de proteínas en la dieta de los atletas que practican fuerza, es que es necesario para la ganancia muscular, y con ello la mejora del rendimiento. Pero tenemos que saber que los atletas pueden necesitar requerir proteínas para algo más que simplemente aliviar el riesgo de deficiencia, inherente a las pautas dietéticas de competición, y como dije anteriormente, ayudar a mejorar la adaptación al estimulo del ejercicio físico. Por esto último, hay una buena razón para recomendar a los atletas la ingesta de proteínas en cierta cantidad mas alta que las recomendaciones de la RDA. El consenso e actual es que la leucina (como mencione varias veces en esta entrada), y posiblemente los otros aminoácidos de cadena ramificada, ocupan una posición de prominencia en la estimulación de la síntesis de proteínas musculares MPS; la ingesta de proteínas en el rango de 1,3-1,8 gramos por kilogramo de peso, consumiendo como unas 3-4 comidas isonitrogenadas maximizará la síntesis de proteínas musculares.
Estas recomendaciones también pueden depender del estado de entrenamiento: los atletas experimentados requerirían menos, mientras que más proteína debería consumirse durante los períodos de alta frecuencia / intensidad de entrenamiento. El consumo elevado de proteína, de 2.0-2,4 gramos por kilogramo de peso, siempre dependiendo del déficit calórico, puede ser ventajoso para prevenir las pérdidas de masa magra durante períodos de restricción energética para promover la pérdida de grasa.
Por último, destacar que por normal general los alimentos que contienen proteínas también contienen grasa y tenemos que tener en cuenta que, el papel que desempeña la fracción de grasa en la regulación de la respuesta de la FRS esta muy poco estudiada. Por ejemplo, la leche entera consumida después del ejercicio de resistencia puede ser más efectiva en estimular la incorporación de aminoácidos en el músculo esquelético que la leche sin grasa, ¿porque? no esta del todo claro… [115]. En resumen, estos puntos demuestran que, para el campo de la nutrición proteínica, aún queda mucho por hacer para optimizar la fuente y la cantidad de proteínas para apoyar la salud como el rendimiento deportivo de nuestros atletas.
Conclusión practica
- Las dietas cetogénicas es un determinante para el rendimiento físico. Afecta negativamente en el atleta, reduciendo la utilización de glucógeno muscular durante el ejercicio, «gracias» a que reduce la glucogenolisis del atleta y por ende su desempeño en alta intensidad.
- El consumo de proteínas puede aumentar las tasas de MPS y, posiblemente, las tasas más bajas de MPB, mejorando así el NPB neto del músculo. La mejoría en la NPB parece acumularse para promover una mayor retención de proteínas en el caso del ejercicio de resistencia y puede mejorar las adaptaciones inducidas por el entrenamiento de fuerza, aunque este último aún no se ha probado.
- Una dosis de proteína que parece estimular al máximo MPS parece estar en el rango de 20-25 g por ingesta de alimento o suero, aunque esta estimación puede ser menor para atletas más ligeros (es decir, <85 kg).
- La proteína puede actuar como algo más que un simple sustrato para suministrar los componentes básicos de la síntesis de proteínas y puede ser un importante desencadenante para afectar los cambios fenotípicos inducidos por el ejercicio. La leucina en particular ocupa una posición prominente y bien puede ser crítica para mejorar la recuperación y la adaptación al ejercicio de fuerza como se detalla anteriormente.
- La velocidad de la digestión de proteínas supuestamente afecta a la respuesta de la MPS y esto parece estar relacionado con la amplitud y la tasa de aumento de la leucina sanguínea (Hiperaminoacidemia) para activar las proteínas clave de señalización mTOR con la consecuente activación de la MPS.
- El momento óptimo para la ingesta de proteínas para promover la recuperación y la adaptación más favorable es después de un estimulo físico. Si bien los datos aún no existen para definir exactamente cuánto tiempo, pero existe cierto tipo de «ventana de oportunidad anabólica». Sin embargo, es más seguro afirmar que los atletas que están interesados en el rendimiento físico, deben consumir proteínas lo antes posible después del ejercicio. Anteriormente hemos visto como inclusive hasta 24 h después del ejercicio de fuerza el músculo permanece sensible a los efectos del ejercicio y demuestra un incremento en la respuesta de la SPM al aumentarse los niveles sanguíneos de aminoácidos. Así que, es razonable pensar que inclusive en momentos posteriores a las 24 h, pareciera haber un aumento en la sensibilidad.
- Para optimizar la proporción de pérdida de masa de tejido graso a magro durante los períodos hipoenergéticos, se recomienda a los atletas que reduzcan su ingesta de carbohidratos hasta un 40% de su ingesta energética (con énfasis en el consumo de carbohidratos de GI inferior), que usualmente significa no más de 3-4 gramos por kilogramo de peso al día, y aumentar su ingesta de proteínas a ~ 20-30% de su consumo de energía o lo que es igual a ~ 1,8-2,7 gramos por kilogramo de peso corporal al día. Pues hemos visto como hay que tener una seria consideración en cómo la ingesta baja de hidratos de carbono debe ir seriamente dictada por el volumen de entrenamiento del atleta. Ya que su rendimiento puede verse gravemente mermado. (ver parte 1º)
- Por otro lado parece que no hay evidencia para recomendar la adición de hidratos de carbono a fuentes de proteínas para optimizar la MPS. Sin embargo es buena opción para realzar la restauración del glucógeno muscular tan importante para el rendimiento de nuestros atletas. (ver parte 1º)
Conclusión general
En este articulo hemos podido ver como las dietas bajas en hidratos de carbono, o el famoso training low competing high en busca de mayores adaptaciones por parte del atleta o mayor adherencia al programa de entrenamiento, no son muy efectivas a largo plazo. También hemos visto como la regulación molecular de nuestro organismo forma una parte crucial en nuestra adaptación al entrenamiento de fuerza, y que dicha adaptación puede ser mejorada por nuestra alimentación. Con pequeño hincapié en la importancia del macronutriente proteico, ya sea ingerido en suero o alimento, desempeña un papel fundamental en la reconstrucción del tejido muscular y por ende en el rendimento deportivo.
Referencias:
[1] K. Baar, The signaling underlying FITness, Appl. Physiol. Nutr. Metab. 34 (2009) 411–419.
[2] B. Egan, J.R. Zierath, Exercise metabolism and the molecular regulation of skeletal muscle adaptation, Cell Metab. 17 (2013) 162–184.
[3] L.G. Weigl, Lost in translation: regulation of skeletal muscle protein synth- esis, Curr. Opin. Pharmacol. 12 (2012) 377–382.
[4] D.G. Hardie, Sensing of energy and nutrients by AMP-activated protein ki- nase, Am. J. Clin. Nutr. 93 (2011) 891S–896S.
[5] F.W. Booth, D.B. Thomason, Molecular and cellular adaptation of muscle in response to exercise: perspectives of various models, Physiol. Rev. 71 (1991) 541–585.
[6] M.J. Gibala, J.P. Little, M. van Essen, G.P. Wilkin, K.A. Burgomaster, A. Safdar, S. Raha, M.A. Tarnopolsky, Short-term sprint interval versus traditional en- durance training: similar initial adaptations in human skeletal muscle and exercise performance, J. Physiol. 575 (2006) 901–911.
[7] A.M. Rivera-Brown, W.R. Frontera, Principles of exercise physiology: re- sponses to acute exercise and long-term adaptations to training, PM&R 4 (2012) 797–804.
[8] C.G. Perry, J. Lally, G.P. Holloway, G.J. Heigenhauser, A. Bonen, L.L. Spriet, Repeated transient mRNA bursts precede increases in transcriptional and mitochondrial proteins during training in human skeletal muscle, J. Physiol. 588 (2010) 4795–4810.
[9] T. Tamura, H. Shiraki, H. Nakagawa, Purification and characterization of adenylate kinase isozymes from rat muscle and liver, Biochim. Biophys. Acta 612 (1980) 56–66.
[10] R.A. Meyer, R.L. Terjung, AMP deamination and IMP reamination in working skeletal muscle, Am. J. Physiol. 239 (1980) C32–C38.
[11] S.K. Trigun, S.N. Singh, Changes in the modulations of kinetics and allosteric properties of muscle phosphofructokinase of young and old rats, Arch. Ger- ontol. Geriatr. 7 (1988) 239–247.
[12] W.W. Winder, D.G. Hardie, Inactivation of acetyl-CoA carboxylase and acti- vation of AMP-activated protein kinase in muscle during exercise, Am. J. Physiol. 270 (1996) E299–E304.
[13] G.J. Gowans, S.A. Hawley, F.A. Ross, D.G. Hardie, AMP is a true physiological regulator of AMP-activated protein kinase by both allosteric activation and enhancing net phosphorylation, Cell Metab. 18 (2013) 556–566.
[14] K. Sakamoto, O. Goransson, D.G. Hardie, D.R. Alessi, Activity of LKB1 and AMPK-related kinases in skeletal muscle: effects of contraction, phenformin, and AICAR, Am. J. Physiol. Endocrinol. Metab. 287 (2004) E310–E317.
[15] N. Alam, E.D. Saggerson, Malonyl-CoA and the regulation of fatty acid oxi- dation in soleus muscle, Biochem. J. 334 (Pt. 1) (1998) 233–241.
[16] C. Pehmoller, J.T. Treebak, J.B. Birk, S. Chen, C. Mackintosh, D.G. Hardie, E.
A. Richter, F. Wojtaszewski, Genetic disruption of AMPK signaling abolishes both contraction- and insulin-stimulated TBC1D1 phosphorylation and 14-3- 3 binding in mouse skeletal muscle, Am. J. Physiol. Endocrinol. Metab. 297 (2009) E665–E675.
[17] K.F. Howlett, A. Mathews, A. Garnham, K. Sakamoto, The effect of exercise and insulin on AS160 phosphorylation and 14-3-3 binding capacity in human skeletal muscle, Am. J. Physiol. Endocrinol. Metab. 294 (2008) E401–E407.
[18] K.F. Howlett, K. Sakamoto, A. Garnham, D. Cameron-Smith, M. Hargreaves, Resistance exercise and insulin regulate AS160 and interaction with 14-3-3 in human skeletal muscle, Diabetes 56 (2007) 1608–1614.
[19] K. Sakamoto, G.D. Holman, Emerging role for AS160/TBC1D4 and TBC1D1 in the regulation of GLUT4 traffic, Am. J. Physiol. Endocrinol. Metab. 295 (2008) E29–E37.
[20] A. McBride, S. Ghilagaber, A. Nikolaev, D.G. Hardie, The glycogen-binding domain on the AMPK beta subunit allows the kinase to act as a glycogen sensor, Cell Metab. 9 (2009) 23–34.
[21] J.D. Bartlett, J. Louhelainen, Z. Iqbal, A.J. Cochran, M.J. Gibala, W. Gregson, G.
- Close, B. Drust, J.P. Morton, Reduced carbohydrate availability enhances exercise-induced p53 signaling in human skeletal muscle: implications for mitochondrial biogenesis, Am. J. Physiol. Regul. Integr. Comp. Physiol. 304 (2013) R450–R458.
[22] J.F. Wojtaszewski, C. MacDonald, J.N. Nielsen, Y. Hellsten, D.G. Hardie, B.
- Kemp, B. Kiens, E.A. Richter, Regulation of 5′AMP-activated protein kinase activity and substrate utilization in exercising human skeletal muscle, Am. J. Physiol. Endocrinol. Metab. 284 (2003) E813–E822.
[23] W.K. Yeo, S.L. McGee, A.L. Carey, C.D. Paton, A.P. Garnham, M. Hargreaves, J.
- Hawley, Acute signalling responses to intense endurance training com- menced with low or normal muscle glycogen, Exp. Physiol. 95 (2010) 351–358.
[24] A. Philp, M.G. MacKenzie, M.Y. Belew, M.C. Towler, A. Corstorphine,
- A. Papalamprou, G. Hardie, K. Baar, Glycogen content regulates peroxisome proliferator activated receptor- partial differential (PPAR-partial differential) activity in rat skeletal muscle, PLoS One 8 (2013) e77200.
[25] C.B. Tanner, S.R. Madsen, D.M. Hallowell, D.M. Goring, T.M. Moore, S.
- Hardman, M.R. Heninger, D.R. Atwood, D.M. Thomson, Mitochondrial and performance adaptations to exercise training in mice lacking skeletal muscle LKB1, Am. J. Physiol. Endocrinol. Metab. 305 (2013) E1018–E1029.
[26] J. Fentz, R. Kjobsted, C.M. Kristensen, J.R. Hingst, J.B. Birk, A. Gudiksen,
- Foretz, P. Schjerling, B. Viollet, H. Pilegaard, J.F. Wojtaszewski, AMPKalpha is essential for acute exercise-induced gene responses but not for exercise training-induced adaptations in mouse skeletal muscle, Am. J. Physiol. En- docrinol. Metab. 00157 (2015) 02015.
[27] S.L. McGee, K.F. Howlett, R.L. Starkie, D. Cameron-Smith, B.E. Kemp,
- Hargreaves, Exercise increases nuclear AMPK alpha2 in human skeletal muscle, Diabetes 52 (2003) 926–928.
[28] S. Jager, C. Handschin, J. St-Pierre, B.M. Spiegelman, AMP-activated protein kinase (AMPK) action in skeletal muscle via direct phosphorylation of PGC-
1alpha, Proc. Natl. Acad. Sci. USA 104 (2007) 12017–12022.
[29] S.L. McGee, D. Sparling, A.L. Olson, M. Hargreaves, Exercise increases MEF2- and GEF DNA-binding activity in human skeletal muscle, FASEB J. 20 (2006) 348–349.
[30] S.L. McGee, B.J. van Denderen, K.F. Howlett, J. Mollica, J.D. Schertzer, B.
Kemp, M. Hargreaves, AMP-activated protein kinase regulates GLUT4 transcription by phosphorylating histone deacetylase 5, Diabetes 57 (2008) 860–867.
[31] S.L. McGee, M. Hargreaves, Histone modifications and exercise adaptations, J. Appl. Physiol. (1985) 110 (2011) 258–263.
[32] A.J. Gilde, M. Van Bilsen, Peroxisome proliferator-activated receptors (PPARS): regulators of gene expression in heart and skeletal muscle, Acta Physiol. Scand. 178 (2003) 425–434.
[33] D.M. Muoio, T.R. Koves, Skeletal muscle adaptation to fatty acid depends on coordinated actions of the PPARs and PGC1 alpha: implications for metabolic disease, Appl. Physiol. Nutr. Metab. 32 (2007) 874–883.
[34] J. Bergstrom, L. Hermansen, E. Hultman, B. Saltin, Diet, muscle glycogen and physical performance, Acta Physiol. Scand. 71 (1967) 140–150.
[35] J.A. Hawley, E.J. Schabort, T.D. Noakes, S.C. Dennis, Carbohydrate-loading and exercise performance. An update, Sports Med. 24 (1997) 73–81.
[36] L.M. Burke, J.A. Hawley, S.H. Wong, A.E. Jeukendrup, Carbohydrates for training and competition, J. Sports Sci. 29 (Suppl. 1) (2011) S17–S27.
[37] T. Stellingwerff, G.R. Cox, Systematic review: carbohydrate supplementation on exercise performance or capacity of varying durations, Appl. Physiol. Nutr. Metab. 39 (2014) 998–1011.
[38] A. Jeukendrup, A step towards personalized sports nutrition: carbohydrate intake during exercise, Sports Med. 44 (Suppl. 1) (2014) S25–S33.
[39] T. Stellingwerff, H. Boon, A.P. Gijsen, J.H. Stegen, H. Kuipers, L.J. van Loon, Carbohydrate supplementation during prolonged cycling exercise spares muscle glycogen but does not affect intramyocellular lipid use, Pflugers Arch.
[40] J.T. Gonzalez, C.J. Fuchs, F.E. Smith, P.E. Thelwall, R. Taylor, E.J. Stevenson, M.
- Trenell, N.M. Cermak, L.J. van Loon, Ingestion of glucose or sucrose pre- vents liver but not muscle glycogen depletion during prolonged endurance- type exercise in trained cyclists, Am. J. Physiol. Endocrinol. Metab. 00376 (2015) 02015.
[41] E.F. Coyle, A.R. Coggan, M.K. Hemmert, J.L. Ivy, Muscle glycogen utilization
during prolonged strenuous exercise when fed carbohydrate, J. Appl. Physiol.
[42] A. Jeukendrup, F. Brouns, A.J. Wagenmakers, W.H. Saris, Carbohydrate– electrolyte feedings improve 1 h time trial cycling performance, Int. J. Sports Med. 18 (1997) 125–129.
[43] J.M. Carter, A.E. Jeukendrup, C.H. Mann, D.A. Jones, The effect of glucose infusion on glucose kinetics during a 1-h time trial, Med. Sci. Sports Exerc. 36 (2004) 1543–1550.
[44] J.M. Carter, A.E. Jeukendrup, D.A. Jones, The effect of carbohydrate mouth
rinse on 1-h cycle time trial performance, Med. Sci. Sports Exerc. 36 (2004)
2107–2111.
[45] L.M. Burke, R.J. Maughan, The Governor has a sweet tooth-mouth sensing of nutrients to enhance sports performance, Eur. J. Sport Sci. 15 (2015) 29–40.
[46] E.S. Chambers, M.W. Bridge, D.A. Jones, Carbohydrate sensing in the human
mouth: effects on exercise performance and brain activity, J. Physiol. 587 (2009) 1779–1794.
[47] S.C. Lane, S.R. Bird, L.M. Burke, J.A. Hawley, Effect of a carbohydrate mouth rinse on simulated cycling time-trial performance commenced in a fed or fasted state, Appl. Physiol. Nutr. Metab. 38 (2013) 134–139.
[48] A.M. Kasper, S. Cocking, M. Cockayne, M. Barnard, J. Tench, L. Parker,
- McAndrew, C. Langan-Evans, G.L. Close, J.P. Morton, Carbohydrate mouth rinse and caffeine improves high-intensity interval running capacity when carbohydrate restricted, Eur. J. Sport Sci. (2015) 1–9.
[49] M.J. Lee, K.M. Hammond, A. Vasdev, K.L. Poole, S.G. Impey, G.L. Close, J.
- P. Morton, Self-selecting fluid intake while maintaining high carbohydrate availability does not impair half-marathon performance, J. Sports Med.
35 (2014) 1216–1222.
[50] B. Pfeiffer, T. Stellingwerff, E. Zaltas, A.E. Jeukendrup, CHO oxidation from a CHO gel compared with a drink during exercise, Med. Sci. Sports Exerc. 42 (2010) 2038–2045.
[51] B. Pfeiffer, T. Stellingwerff, E. Zaltas, A.E. Jeukendrup, Oxidation of solid versus liquid CHO sources during exercise, Med. Sci. Sports Exerc. 42 (2010)
2030–2037.
[52] X. Zhang, N. O’Kennedy, J.P. Morton, Extreme variation of nutritional com- position and osmolality of commercially available carbohydrate energy gels, Int. J. Sport Nutr. Exerc. Metab. 25 (2015) 504–509.
[53] B. Pfeiffer, T. Stellingwerff, A.B. Hodgson, R. Randell, K. Pottgen, P. Res, A.
- Jeukendrup, Nutritional intake and gastrointestinal problems during competitive endurance events, Med. Sci. Sports Exerc. 44 (2012) 344–351.
[54] E.P. de Oliveira, R.C. Burini, A. Jeukendrup, Gastrointestinal complaints dur-
ing exercise: prevalence, etiology, and nutritional recommendations, Sports
Med. 44 (Suppl. 1) (2014) S79–S85.
[55] W.K. Yeo, C.D. Paton, A.P. Garnham, L.M. Burke, A.L. Carey, J.A. Hawley, Skeletal muscle adaptation and performance responses to once a day versus twice every second day endurance training regimens, J. Appl. Physiol. 105 (2008) 1462–1470.
[56] J.J. Widrick, D.L. Costill, W.J. Fink, M.S. Hickey, G.K. McConell, H. Tanaka, Carbohydrate feedings and exercise performance: effect of initial muscle glycogen concentration, J. Appl. Physiol. (1985) 74 (1993) 2998–3005.
[57] J.A. Hawley, J.P. Morton, Ramping up the signal: promoting endurance
training adaptation in skeletal muscle by nutritional manipulation, Clin. Exp. Pharmacol. Physiol. 41 (2014) 608–613.
[58] J.D. Bartlett, J.A. Hawley, J.P. Morton, Carbohydrate availability and exercise
training adaptation: too much of a good thing? Eur. J. Sport Sci. 15 (2015)
3–12.
[59] J.P. Morton, L. Croft, J.D. Bartlett, D.P. Maclaren, T. Reilly, L. Evans, A. McArdle, B. Drust, Reduced carbohydrate availability does not modulate training-in- duced heat shock protein adaptations but does upregulate oxidative enzyme activity in human skeletal muscle, J. Appl. Physiol. 106 (2009)
1513–1521.
[60] K. Van Proeyen, K. Szlufcik, H. Nielens, M. Ramaekers, P. Hespel, Beneficial metabolic adaptations due to endurance exercise training in the fasted state, J. Appl. Physiol. (1985) 110 (2011) 236–245.
[61] C.J. Hulston, M.C. Venables, C.H. Mann, C. Martin, A. Philp, K. Baar, A.
- Jeukendrup, Training with low muscle glycogen enhances fat metabolism in well-trained cyclists, Med. Sci. Sports Exerc. 42 (2010) 2046–2055.
[62] A.K. Hansen, C.P. Fischer, P. Plomgaard, J.L. Andersen, B. Saltin, B.K. Pedersen, Skeletal muscle adaptation: training twice every second day vs. training once daily, J. Appl. Physiol. (1985) 98 (2005) 93–99.
[63] A.J. Cochran, F. Myslik, M.J. MacInnis, M.E. Percival, D. Bishop, M.
- A. Tarnopolsky, J. Gibala, Manipulating carbohydrate availability between twice-daily sessions of high-intensity interval training over 2 weeks im- proves time-trial performance, Int. J. Sport Nutr. Exerc. Metab. 25 (2015)
463–470.
[64] L.M. Burke, Fueling strategies to optimize performance: training high or training low? Scand. J. Med. Sci. Sports 20 (Suppl. 2) (2010) 48–58.
[65] A.J. Cochran, J.P. Little, M.A. Tarnopolsky, M.J. Gibala, Carbohydrate feeding during recovery alters the skeletal muscle metabolic response to repeated sessions of high-intensity interval exercise in humans, J. Appl. Physiol. 108 (2010) 628–636.
[66] N. Psilander, P. Frank, M. Flockhart, K. Sahlin, Exercise with low glycogen
increases PGC-1alpha gene expression in human skeletal muscle, Eur. J. Appl. Physiol. 113 (2013) 951–963.
[67] D.C. Nieman, Marathon training and immune function, Sports Med. 37
(2007) 412–415.
[68] G.R. Cox, S.A. Clark, A.J. Cox, S.L. Halson, M. Hargreaves, J.A. Hawley,
- Jeacocke, R.J. Snow, W.K. Yeo, L.M. Burke, Daily training with high car- bohydrate availability increases exogenous carbohydrate oxidation during endurance cycling, J. Appl. Physiol. (1985) 109 (2010) 126–134.
[69] K.R. Howarth, N.A. Moreau, S.M. Phillips, M.J. Gibala, Coingestion of protein with carbohydrate during recovery from endurance exercise stimulates skeletal muscle protein synthesis in humans, J. Appl. Physiol. 106 (2009)
1394–1402.
[70] S.G. Impey, D. Smith, A.L. Robinson, D.J. Owens, J.D. Bartlett, K. Smith,
- Limb, J. Tang, W.D. Fraser, G.L. Close, J.P. Morton, Leucine-enriched protein feeding does not impair exercise-induced free fatty acid availability and lipid oxidation: beneficial implications for training in carbohydrate-restricted states, Amino Acids 47 (2015) 407–416.
[71] H. Pilegaard, T. Osada, L.T. Andersen, J.W. Helge, B. Saltin, P.D. Neufer, Sub- strate availability and transcriptional regulation of metabolic genes in hu- man skeletal muscle during recovery from exercise, Metabolism 54 (2005)
1048–1055.
[72] S.C. Lane, D.M. Camera, D.G. Lassiter, J.L. Areta, S.R. Bird, W.K. Yeo, N.
- A. Jeacocke, A. Krook, R. Zierath, L.M. Burke, J.A. Hawley, Effects of sleeping with reduced carbohydrate availability on acute training responses, J. Appl. Physiol. (1985) 119 (2015) 643–655.
[73] L. Burke, Re-Examining High-Fat Diets for Sports Performance: Did We Call the ‘Nail in the Coffin’ Too Soon? Sports Med., 2015 (November 9:epub ahead of print).
[74] J.S. Volek, T. Noakes, S.D. Phinney, Rethinking fat as a fuel for endurance
exercise, Eur. J. Sport Sci. 15 (2015) 13–20.
[75] S.D. Phinney, B.R. Bistrian, W.J. Evans, E. Gervino, G.L. Blackburn, The human metabolic response to chronic ketosis without caloric restriction: preserva- tion of submaximal exercise capability with reduced carbohydrate oxidation, Metabolism 32 (1983) 769–776.
[76] W.K. Yeo, A.L. Carey, L. Burke, L.L. Spriet, J.A. Hawley, Fat adaptation in well- trained athletes: effects on cell metabolism, Appl. Physiol. Nutr. Metab. 36 (2011) 12–22.
[77] L. Havemann, S.J. West, J.H. Goedecke, I.A. Macdonald, A. St. Clair Gibson, T.
- Noakes, E.V. Lambert, Fat adaptation followed by carbohydrate loading compromises high-intensity sprint performance, J. Appl. Physiol. (1985) 100 (2006) 194–202.
[78] T. Stellingwerff, L.L. Spriet, M.J. Watt, N.E. Kimber, M. Hargreaves, J.A. Hawley,
L.M. Burke, P.D.H. Decreased, activation and glycogenolysis during exercise following fat adaptation with carbohydrate restoration, Am. J. Physiol. En- docrinol. Metab. 290 (2006) E380–E388.
[79] L.M. Burke, B. Kiens, “Fat adaptation” for athletic performance: the nail in the coffin? J. Appl. Physiol. (1985) 100 (2006) 7–8.
[80] A.D. Faigenbaum, R.S. Lloyd, J. MacDonald, G.D. Myer, Citius, Altius, Fortius: beneficial effects of resistance training for young athletes, Br. J. Sports Med. (2015).
[81] T. Moritani, H.A. deVries, Neural factors versus hypertrophy in the time course of muscle strength gain, Am. J. Phys. Med. 58 (1979) 115–130.
[82] O.R. Seynnes, M. de Boer, M.V. Narici, Early skeletal muscle hypertrophy and architectural changes in response to high-intensity resistance training, J. Appl. Physiol. (1985) 102 (2007) 368–373.
[83] T.A. Churchward-Venne, N.A. Burd, S.M. Phillips, Nutritional regulation of
muscle protein synthesis with resistance exercise: strategies to enhance anabolism, Nutr. Metab. (Lond.) 9 (2012) 40.
[84] N.M. Cermak, P.T. Res, L.C. de Groot, W.H. Saris, L.J. van Loon, Protein sup-
plementation augments the adaptive response of skeletal muscle to re- sistance-type exercise training: a meta-analysis, Am. J. Clin. Nutr. 96 (2012)
1454–1464.
[85] K. Baar, K. Esser, Phosphorylation of p70(S6k) correlates with increased skeletal muscle mass following resistance exercise, Am. J. Physiol. 276 (1999) C120–C127.
[86] Y.W. Chen, G.A. Nader, K.R. Baar, M.J. Fedele, E.P. Hoffman, K.A. Esser, Re-
sponse of rat muscle to acute resistance exercise defined by transcriptional and translational profiling, J. Physiol. 545 (2002) 27–41.
[87] A. Chesley, J.D. MacDougall, M.A. Tarnopolsky, S.A. Atkinson, K. Smith,
Changes in human muscle protein synthesis after resistance exercise, J. Appl. Physiol. (1985) 73 (1992) 1383–1388.
[88] J.J. McCarthy, K.A. Esser, Anabolic and catabolic pathways regulating skeletal muscle mass, Curr. Opin. Clin. Nutr. Metab. Care 13 (2010) 230–235.
[89] S.C. Bodine, T.N. Stitt, M. Gonzalez, W.O. Kline, G.L. Stover, R. Bauerlein,
- Zlotchenko, A. Scrimgeour, J.C. Lawrence, D.J. Glass, G.D. Yancopoulos, Akt/ mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo, Nat. Cell Biol. 3 (2001) 1014–1019.
[90] J.M. Dickinson, C.S. Fry, M.J. Drummond, D.M. Gundermann, D.K. Walker, E.
- Glynn, K.L. Timmerman, S. Dhanani, E. Volpi, B.B. Rasmussen, Mammalian target of rapamycin complex 1 activation is required for the stimulation of human skeletal muscle protein synthesis by essential amino acids, J. Nutr.
[91] M.J. Drummond, C.S. Fry, E.L. Glynn, H.C. Dreyer, S. Dhanani, K.
- Timmerman, E. Volpi, B.B. Rasmussen, Rapamycin administration in hu- mans blocks the contraction-induced increase in skeletal muscle protein synthesis, J. Physiol. 587 (2009) 1535–1546.
[92] V. Mieulet, M. Roceri, C. Espeillac, A. Sotiropoulos, M. Ohanna, V. Oorschot,
- Klumperman, M. Sandri, M. Pende, S6 kinase inactivation impairs growth and translational target phosphorylation in muscle cells maintaining proper regulation of protein turnover, Am. J. Physiol. Cell Physiol. 293 (2007) C712–C722.
[93] M. Ohanna, A.K. Sobering, T. Lapointe, L. Lorenzo, C. Praud, E. Petroulakis,
- Sonenberg, P.A. Kelly, A. Sotiropoulos, M. Pende, Atrophy of S6K1( / ) skeletal muscle cells reveals distinct mTOR effectors for cell cycle and size control, Nat. Cell Biol. 7 (2005) 286–294.
[94] X. Zheng, Y. Liang, Q. He, R. Yao, W. Bao, L. Bao, Y. Wang, Z. Wang, Current models of mammalian target of rapamycin complex 1 (mTORC1) activation by growth factors and amino acids, Int. J. Mol. Sci. 15 (2014) 20753–20769.
[95] M.G. Mackenzie, D.L. Hamilton, J.T. Murray, K. Baar, mVps34 is activated by an acute bout of resistance exercise, Biochem. Soc. Trans. 35 (2007)
1314–1316.
[96] K.M. Dodd, A.R. Tee, Leucine and mTORC1: a complex relationship, Am. J.
Physiol. Endocrinol. Metab. 302 (2012) E1329–E1342.
[97] G.R. Christie, E. Hajduch, H.S. Hundal, C.G. Proud, P.M. Taylor, Intracellular sensing of amino acids in Xenopus laevis oocytes stimulates p70 S6 kinase in a target of rapamycin-dependent manner, J. Biol. Chem. 277 (2002)
9952–9957.
[98] S.J. Crozier, S.R. Kimball, S.W. Emmert, J.C. Anthony, L.S. Jefferson, Oral leu- cine administration stimulates protein synthesis in rat skeletal muscle, J. Nutr. 135 (2005) 376–382.
[99] P.L. Greenhaff, L.G. Karagounis, N. Peirce, E.J. Simpson, M. Hazell, R. Layfield, H. Wackerhage, K. Smith, P. Atherton, A. Selby, M.J. Rennie, Disassociation between the effects of amino acids and insulin on signaling, ubiquitin li- gases, and protein turnover in human muscle, Am. J. Physiol. Endocrinol. Metab. 295 (2008) E595–E604.
[100] A. Beugnet, A.R. Tee, P.M. Taylor, C.G. Proud, Regulation of targets of mTOR (mammalian target of rapamycin) signalling by intracellular amino acid availability, Biochem. J. 372 (2003) 555–566.
[101] L. Bar-Peled, D.M. Sabatini, Regulation of mTORC1 by amino acids, Trends Cell
[102] J.S. You, H.C. Lincoln, C.R. Kim, J.W. Frey, C.A. Goodman, X.P. Zhong, T.
- A. Hornberger, The role of diacylglycerol kinase zeta and phosphatidic acid in the mechanical activation of mammalian target of rapamycin (mTOR) sig- naling and skeletal muscle hypertrophy, Biol. Chem. 289 (2014) 1551–1563.
[103] W. Apro, M. Moberg, D.L. Hamilton, B. Ekblom, O. Rooyackers, H.C. Holm- berg, E. Blomstrand, Leucine does not affect mechanistic target of rapamycin complex 1 assembly but is required for maximal ribosomal protein s6 kinase
1 activity in human skeletal muscle following resistance exercise, FASEB J.,
2015.
[104] K.D. Tipton, A.A. Ferrando, S.M. Phillips, D. Doyle Jr., R.R. Wolfe, Postexercise net protein synthesis in human muscle from orally administered amino acids, Am. J. Physiol. 276 (1999) E628–E634.
[105] D.R. Moore, M.J. Robinson, J.L. Fry, J.E. Tang, E.I. Glover, S.B. Wilkinson,
- T. Prior, A. Tarnopolsky, S.M. Phillips, Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men, Am. J. Clin. Nutr. 89 (2009) 161–168.
[106] O.C. Witard, S.R. Jackman, L. Breen, K. Smith, A. Selby, K.D. Tipton, Myofi–
brillar muscle protein synthesis rates subsequent to a meal in response to increasing doses of whey protein at rest and after resistance exercise, Am. J. Clin. Nutr. 99 (2014) 86–95.
[107] L. Breen, T.A. Churchward-Venne, Leucine: a nutrient ‘trigger’ for muscle anabolism, but what more? J. Physiol. 590 (2012) 2065–2066.
[108] D.J. Wilkinson, T. Hossain, D.S. Hill, B.E. Phillips, H. Crossland, J. Williams, P. Loughna, T.A. Churchward-Venne, L. Breen, S.M. Phillips, T. Etheridge, J.
- A. Rathmacher, Smith, N.J. Szewczyk, P.J. Atherton, Effects of leucine and its metabolite beta-hydroxy-beta-methylbutyrate on human skeletal muscle protein metabolism, J. Physiol. 591 (2013) 2911–2923.
[109] D.R. Moore, T.A. Churchward-Venne, O. Witard, L. Breen, N.A. Burd, K.
- Tipton, S.M. Phillips, Protein ingestion to stimulate myofibrillar protein synthesis requires greater relative protein intakes in healthy older versus younger men, J. Gerontol. A: Biol. Sci. Med. Sci. 70 (2015) 57–62.
[110] S.M. Phillips, V.L. Fulgoni 3rd, R.P. Heaney, T.A. Nicklas, J.L. Slavin, C.
- Weaver, Commonly consumed protein foods contribute to nutrient intake, diet quality, and nutrient adequacy, Am. J. Clin. Nutr. (2015).
[111] S.M. Phillips, M.B. Zemel, Effect of protein, dairy components and energy balance in optimizing body composition, Nestle Nutrition Institute Workshop Series, 69, 2011, pp. 97–108 (discussion 108–113).
[112] M.C. Devries, S.M. Phillips, Supplemental protein in support of muscle mass and health: advantage whey, J. Food Sci. 80 (Suppl. 1) (2015) A8–A15.
[113] A.B. Nongonierma, R.J. FitzGerald, Bioactive properties of milk proteins in humans: a review, Peptides 73 (2015) 20–34.
[114] A.B. Nongonierma, R.J. FitzGerald, Milk proteins as a source of tryptophan- containing bioactive peptides, Food Funct. 6 (2015) 2115–2127.
[115] T.A. Elliot, M.G. Cree, A.P. Sanford, R.R. Wolfe, K.D. Tipton, Milk ingestion stimulates net muscle protein synthesis following resistance exercise, Med. Sci. Sports Exerc. 38 (2006) 667–674.
[116] J.J. Knapik, R.A. Steelman, S.S. Hoedebecke, K.G. Austin, E.K. Farina, H.
- Lieberman, Prevalence of dietary supplement use by athletes: systematic review and meta-analysis, Sports Med. (2015).
[117] J.J. Knapik, R.A. Steelman, S.S. Hoedebecke, E.K. Farina, K.G. Austin, H.
- Lieberman, A systematic review and meta-analysis on the prevalence of dietary supplement use by military personnel, BMC Complement. Altern. Med. 14 (2014) 143.
[118] S. Outram, B. Stewart, Doping through supplement use: a review of the available empirical data, Int. J. Sport Nutr. Exerc. Metab. 25 (2015) 54–59.
[119] L. Burke, B. Desbrow, L. Spriet, Caffeine for Sports Performance, Human Ki- netics, Champaign, Illinois, 2013.
[120] L.L. Spriet, Exercise and sport performance with low doses of caffeine, Sports
Med. 44 (Suppl. 2) (2014) S175–S184.
[121] L.M. Burke, Caffeine and sports performance, Appl. Physiol. Nutr. Metab. 33 (2008) 1319–1334.
[122] S.C. Lane, J.L. Areta, S.R. Bird, V.G. Coffey, L.M. Burke, B. Desbrow, L.
- Karagounis, J.A. Hawley, Caffeine ingestion and cycling power output in a low or normal muscle glycogen state, Med. Sci. Sports Exerc. 45 (2013)
1577–1584.
[123] C.J. Womack, M.J. Saunders, M.K. Bechtel, D.J. Bolton, M. Martin, N.D. Luden, W. Dunham, M. Hancock, The influence of a CYP1A2 polymorphism on the ergogenic effects of caffeine, J. Int. Soc. Sports Nutr. 9 (2012) 7.
[124] R.C. Harris, K. Soderlund, E. Hultman, Elevation of creatine in resting and
exercised muscle of normal subjects by creatine supplementation, Clin. Sci. (Lond.) 83 (1992) 367–374.
[125] T.W. Buford, R.B. Kreider, J.R. Stout, M. Greenwood, B. Campbell, M. Spano, T. Ziegenfuss, H. Lopez, J. Landis, J. Antonio, International Society of Sports
Nutrition position stand: creatine supplementation and exercise, J. Int. Soc. Sports Nutr. 4 (2007) 6.
[126] A. Safdar, N.J. Yardley, R. Snow, S. Melov, M.A. Tarnopolsky, Global and tar-
geted gene expression and protein content in skeletal muscle of young men following short-term creatine monohydrate supplementation, Physiol. Gen- om. 32 (2008) 219–228.
[127] B. Gualano, H. Roschel, A.H. Lancha Jr., C.E. Brightbill, E.S. Rawson, In sickness and in health: the widespread application of creatine supplementation, Amino Acids 43 (2012) 519–529.
[128] V.J. Dalbo, M.D. Roberts, J.R. Stout, C.M. Kerksick, Putting to rest the myth of
creatine supplementation leading to muscle cramps and dehydration, Br. J. Sports Med. 42 (2008) 567–573.
[129] L.M. Burke, To beet or not to beet? J. Appl. Physiol. (1985) 115 (2013) 311–312.
[130] A.M. Jones, Dietary nitrate supplementation and exercise performance, Sports Med. 44 (Suppl. 1) (2014) S35–S45.
[131] K.L. Jonvik, J. Nyakayiru, L.J. van Loon, L.B. Verdijk, Can elite athletes benefit from dietary nitrate supplementation? J. Appl. Physiol. (1985) 119 (2015)
759–761.
[132] M. Hultstrom, C. Amorim de Paula, M. Antonio Peliky Fontes, S. Porcelli, G. Bellistri, L. Pugliese, L. Rasica, M. Marzorati, G. Pavei, S.K. Ferguson, C.
- T. Holdsworth, T.I. Musch, C. Poole, N. Bourdillon, M.W. Hoon, L.M. Burke, D.W. Michielli, R. Faiss, G.P. Millet, B.T. Corona, M.S. Green, A.L. da Silveira, A. L. Sindler, D.P. Casey, B.D. Johnson, C.M. Wheatley, L.J. Kunces, R. Bescos, L. C. Cody, C.R. Martens, J.N. Justice, S.B. Ballak, D.B. Ballak, S.P. Wanner,
- Rehman, Commentaries on Viewpoint: can elite athletes benefit from dietary nitrate supplementation? J. Appl. Physiol. (1985) 119 (2015) 762–769.
[133] L. Burke, Practical considerations for bicarbonate loading and sports perfor- mance, in: K. Tipton, L. van Loon (Eds.), Nutritional Strategy to Modulate Training Efficiency, 2013 (15-12).
[134] A.J. Carr, W.G. Hopkins, C.J. Gore, Effects of acute alkalosis and acidosis on performance: a meta-analysis, Sports Med. 41 (2011) 801–814.
[135] A.J. Carr, G.J. Slater, C.J. Gore, B. Dawson, L.M. Burke, Effect of sodium bi- carbonate on [HCO3-], pH, and gastrointestinal symptoms, Int. J. Sport Nutr. Exerc. Metab. 21 (2011) 189–194.
[136] T. Stellingwerff, J. Decombaz, R.C. Harris, C. Boesch, Optimizing human in vivo
dosing and delivery of beta-alanine supplements for muscle carnosine synthesis, Amino Acids (2012).
[137] S. Stegen, T. Bex, C. Vervaet, L. Vanhee, E. Achten, W. Derave, Beta-alanine
dose for maintaining moderately elevated muscle carnosine levels, Med. Sci. Sports Exerc. 46 (2014) 1426–1432.
[138] L. Blancquaert, I. Everaert, W. Derave, Beta-alanine supplementation, muscle carnosine and exercise performance, Curr. Opin. Clin. Nutr. Metab. Care 18 (2015) 63–70.
[139] M.B. Demay, Mechanism of vitamin D receptor action, Ann. N. Y. Acad. Sci.
[140] G.L. Close, J. Russell, J.N. Cobley, D.J. Owens, G. Wilson, W. Gregson, W.
- Fraser, J.P. Morton, Assessment of vitamin D concentration in non-sup- plemented professional athletes and healthy adults during the winter months in the UK: implications for skeletal muscle function, J. Sports Sci. 31 (2013) 344–353.
[141] S.A. Hamilton, R. McNeil, B.W. Hollis, D.J. Davis, J. Winkler, C. Cook, G. Warner, B. Bivens, P. McShane, C.L. Wagner, Profound vitamin D deficiency in a di- verse group of women during pregnancy living in a sun-rich environment at latitude 32°N, Int. J. Endocrinol. 2010 (2010) 917428.
[142] D.J. Owens, W.D. Fraser, G.L. Close, Vitamin D and the athlete: emerging in-
sights, Eur. J. Sport Sci. 15 (2015) 73–84.
[143] R. Vieth, H. Bischoff-Ferrari, B.J. Boucher, B. Dawson-Hughes, C.F. Garland, R.
- P. Heaney, F. Holick, B.W. Hollis, C. Lamberg-Allardt, J.J. McGrath, A.
- W. Norman, Scragg, S.J. Whiting, W.C. Willett, A. Zittermann, The urgent need to recommend an intake of vitamin D that is effective, Am. J. Clin. Nutr.
[144] A. Zittermann, Vitamin D in preventive medicine: are we ignoring the evi- dence? Br. J. Nutr. 89 (2003) 552–572.
[145] D.J. Owens, D. Webber, S.G. Impey, J. Tang, T.F. Donovan, W.D. Fraser, J.
- P. Morton, L. Close, Vitamin D supplementation does not improve human skeletal muscle contractile properties in insufficient young males, Eur. J. Appl. Physiol. 114 (2014) 1309–1320.
[146] C. Agostoni, J. Bresson, S. Fairweather-Tait, A. Flynn, I. Golly, H. Korhonen,
- P. Lagiou, Lovik, R. Marchelli, A. Martin, B. Moseley, M. Neuhauser-Bert- hold, H. Przyrembel, S. Salminen, Y. Sanz, S. Strain, S. Strobel, I. Tetens,
- Tome, H. van Loveren, H. Verhagen, Scientific opinion on the tolerable upper intake level of vitamin D, Eur. Food Saf. Auth. J. 10 (2012) 2813.
[147] D.J. Owens, A.P. Sharples, I. Polydorou, N. Alwan, T.F. Donovan, J. Tang, R.
- Cooper, W.D. Fraser, J.P. Morton, C. Stewart, G.L. Close, A systems based investigation into vitamin D and skeletal muscle repair, regeneration and hypertrophy, Am. J. Physiol. Endocrinol. Metab. 00375 (2015) 02015.
[148] J.N. Cobley, H. McHardy, J.P. Morton, M.G. Nikolaidis, G.L. Close, Influence of vitamin C and vitamin E on redox signaling: implications for exercise adaptations, Free Radic. Biol. Med. 84 (2015) 65–76.
[149] J.N. Cobley, N.V. Margaritelis, J.P. Morton, G.L. Close, M.G. Nikolaidis, J.
- Malone, The basic chemistry of exercise-induced DNA oxidation: oxidative damage, redox signaling, and their interplay, Front. Physiol. 6 (2015) 182.
[150] G. Paulsen, H. Hamarsland, K.T. Cumming, R.E. Johansen, J.J. Hulmi,
- Borsheim, H. Wiig, I. Garthe, T. Raastad, Vitamin C and E supplementation alters protein signalling after a strength training session, but not muscle growth during 10 weeks of training, J. Physiol. 592 (2014) 5391–5408.
[151] D. Morrison, J. Hughes, P.A. Della Gatta, S. Mason, S. Lamon, A.P. Russell, G.
- Wadley, Vitamin C and E supplementation prevents some of the cellular adaptations to endurance-training in humans, Free Radic. Biol. Med. 89 (2015) 852–862.
[152] D. Thompson, C. Williams, S.J. McGregor, C.W. Nicholas, F. McArdle, M.
- Jackson, J.R. Powell, Prolonged vitamin C supplementation and recovery from demanding exercise, Int. J. Sport Nutr. Exerc. Metab. 11 (2001) 466–481.
[153] M.C. Gomez-Cabrera, J. Vina, L.L. Ji, Interplay of oxidants and antioxidants
during exercise: implications for muscle health, Phys. Sportsmed. 37 (2009)
116–123.
[154] M.C. Gomez-Cabrera, C. Borras, F.V. Pallardo, J. Sastre, L.L. Ji, J. Vina, De- creasing xanthine oxidase-mediated oxidative stress prevents useful cellular adaptations to exercise in rats, J. Physiol. 567 (2005) 113–120.
[155] M. Ristow, K. Zarse, A. Oberbach, N. Kloting, M. Birringer, M. Kiehntopf,
- Stumvoll, C.R. Kahn, M. Bluher, Antioxidants prevent health-promoting effects of physical exercise in humans, Proc. Natl. Acad. Sci. USA 106 (2009)
8665–8670.
[156] B. Halliwell, M. Whiteman, Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean? Br. J. Pharmacol. 142 (2004) 231–255.
[157] H. Sies, Total antioxidant capacity: appraisal of a concept, J. Nutr. 137 (2007)
1493–1495.
[158] H.J. Forman, O. Augusto, R. Brigelius-Flohe, P.A. Dennery, B. Kalyanaraman, H. Ischiropoulos, G.E. Mann, R. Radi, L.J. Roberts 2nd, J. Vina, K.J. Davies, Even free radicals should follow some rules: a guide to free radical research ter- minology and methodology, Free Radic. Biol. Med. 78 (2015) 233–235.
[159] M.P. Murphy, A. Holmgren, N.G. Larsson, B. Halliwell, C.J. Chang,
- Kalyanaraman, S.G. Rhee, P.J. Thornalley, L. Partridge, D. Gems, T. Nystrom, V. Belousov, P.T. Schumacker, C.C. Winterbourn, Unraveling the biological roles of reactive oxygen species, Cell Metab. 13 (2011) 361–366.
[160] A.C. Petersen, M.J. McKenna, I. Medved, K.T. Murphy, M.J. Brown, P. Della
Gatta, D. Cameron-Smith, Infusion with the antioxidant N-acetylcysteine attenuates early adaptive responses to exercise in human skeletal muscle, Acta Physiol. (Oxf.) 204 (2012) 382–392.
[161] J. Cobley, C. McGlory, J. Morton, G.L. Close, N-acetylcysteine’s attenuation of fatigue after repeated bouts of intermittent exercise: practical implications for tournament situations, Int. J. Sport Nutr. Exerc. Metab. 21 (2011) 451–461.
[162] M.B. Reid, Free radicals and muscle fatigue: of ROS, canaries, and the IOC,
Free Radic. Biol. Med. 44 (2008) 169–179.
[163] G. Howatson, M.P. McHugh, J.A. Hill, J. Brouner, A.P. Jewell, K.A. van Someren, R.E. Shave, S.A. Howatson, Influence of tart cherry juice on indices of recovery following marathon running, Scand. J. Med. Sci. Sports 20 (2010) 843–852.
[164] G.L. Close, M.J. Jackson, Antioxidants and exercise: a tale of the complexities
of relating signalling processes to physiological function? J. Physiol. 592 (2014) 1721–1722.
[165] B. Buijsse, C. Weikert, D. Drogan, M. Bergmann, H. Boeing, Chocolate con-
sumption in relation to blood pressure and risk of cardiovascular disease in
German adults, Eur. Heart J. 31 (2010) 1616–1623.
[166] L. Nogueira, I. Ramirez-Sanchez, G.A. Perkins, A. Murphy, P.R. Taub,
- Ceballos, F.J. Villarreal, M.C. Hogan, M.H. Malek, (–)-Epicatechin enhances fatigue resistance and oxidative capacity in mouse muscle, J. Physiol. 589 (2011) 4615–4631.
[167] G. Gutierrez-Salmean, P. Ortiz-Vilchis, C.M. Vacaseydel, I. Rubio-Gayosso,
- Meaney, F. Villarreal, I. Ramirez-Sanchez, G. Ceballos, Acute effects of an oral supplement of (–)-epicatechin on postprandial fat and carbohydrate metabolism in normal and overweight subjects, Food Funct. 5 (2014)
521–527.
[168] D. MacKay, J. Hathcock, E. Guarneri, Niacin: chemical forms, bioavailability, and health effects, Nutr. Rev. 70 (2012) 357–366.
[169] P. Bieganowski, C. Brenner, Discoveries of nicotinamide riboside as a nutrient and conserved NRK genes establish a Preiss–Handler independent route to NAD þ in fungi and humans, Cell 117 (2004) 495–502.
[170] C. Canto, K.J. Menzies, J. Auwerx, NAD( þ ) metabolism and the control of
energy homeostasis: a balancing act between mitochondria and the nucleus, Cell Metab. 22 (2015) 31–53.
[171] C. Canto, R.H. Houtkooper, E. Pirinen, D.Y. Youn, M.H. Oosterveer, Y. Cen, P.
- Fernandez-Marcos, H. Yamamoto, P.A. Andreux, P. Cettour-Rose,
- Gademann, C. Rinsch, K. Schoonjans, A.A. Sauve, J. Auwerx, The NAD( þ ) precursor nicotinamide riboside enhances oxidative metabolism and protects against high-fat diet-induced obesity, Cell Metab. 15 (2012) 838–847.
[172] S. Pervaiz, Resveratrol: from grapevines to mammalian biology, FASEB J. 17
(2003) 1975–1985.
[173] M. de Ligt, S. Timmers, P. Schrauwen, Resveratrol and obesity: can resveratrol relieve metabolic disturbances? Biochim. Biophys. Acta 1852 (2015)
1137–1144.
[174] T. Murase, S. Haramizu, N. Ota, T. Hase, Suppression of the aging-associated decline in physical performance by a combination of resveratrol intake and habitual exercise in senescence-accelerated mice, Biogerontology 10 (2009)
[175] S. Timmers, E. Konings, L. Bilet, R.H. Houtkooper, T. van de Weijer, G.
- Goossens, J. Hoeks, S. van der Krieken, D. Ryu, S. Kersten, E. Moonen- Kornips, M.K. Hesselink, I. Kunz, V.B. Schrauwen-Hinderling, E.E. Blaak,
- Auwerx, P. Schrauwen, Calorie restriction-like effects of 30 days of re-
sveratrol supplementation on energy metabolism and metabolic profile in obese humans, Cell Metab. 14 (2011) 612–622.
[176] T.D. Scribbans, J.K. Ma, B.A. Edgett, K.A. Vorobej, A.S. Mitchell, J.G. Zelt, C.
- A. Simpson, Quadrilatero, B.J. Gurd, Resveratrol supplementation does not augment performance adaptations or fibre-type-specific responses to high- intensity interval training in humans, Appl. Physiol. Nutr. Metab. 39 (2014)
1305–1313.
[177] L. Gliemann, J.F. Schmidt, J. Olesen, R.S. Bienso, S.L. Peronard, S.U. Grandjean, S.P. Mortensen, M. Nyberg, J. Bangsbo, H. Pilegaard, Y. Hellsten, Resveratrol blunts the positive effects of exercise training on cardiovascular health in aged men, J. Physiol. 591 (2013) 5047–5059.
[178] J. Olesen, L. Gliemann, R. Bienso, J. Schmidt, Y. Hellsten, H. Pilegaard, Exercise training, but not resveratrol, improves metabolic and inflammatory status in skeletal muscle of aged men, J. Physiol. 592 (2014) 1873–1886.
[179] P.J. Atherton, K. Smith, Muscle protein synthesis in response to nutrition and exercise, J. Physiol. 590 (2012) 1049–1057.
[180] S. Nissen, R. Sharp, M. Ray, J.A. Rathmacher, D. Rice, J.C. Fuller Jr., A.
- Connelly, N. Abumrad, Effect of leucine metabolite beta-hydroxy-beta- methylbutyrate on muscle metabolism during resistance-exercise training, J. Appl. Physiol. (1985) 81 (1996) 2095–2104.
[181] K. Athenstaedt, G. Daum, Phosphatidic acid, a key intermediate in lipid me- tabolism, Eur. J. Biochem. 266 (1999) 1–16.
[182] Y. Fang, M. Vilella-Bach, R. Bachmann, A. Flanigan, J. Chen, Phosphatidic acid- mediated mitogenic activation of mTOR signaling, Science 294 (2001)
1942–1945.
[183] J.R. Hoffman, J.R. Stout, D.R. Williams, A.J. Wells, M.S. Fragala, G.T. Mangine, A.
- Gonzalez, N.S. Emerson, W.P. McCormack, T.C. Scanlon, M. Purpura,
- Jager, Efficacy of phosphatidic acid ingestion on lean body mass, muscle thickness and strength gains in resistance-trained men, J. Int. Soc. Sports Nutr. 9 (2012) 47.
[184] J.M. Joy, D.M. Gundermann, R.P. Lowery, R. Jager, S.A. McCleary, M. Purpura, M.D. Roberts, S.M. Wilson, T.A. Hornberger, J.M. Wilson, Phosphatidic acid enhances mTOR signaling and resistance exercise induced hypertrophy, Nutr. Metab. (Lond.) 11 (2014) 29.
[185] C.B. Mobley, T.A. Hornberger, C.D. Fox, J.C. Healy, B.S. Ferguson, R.P. Lowery, R.
- McNally, C.M. Lockwood, J.R. Stout, A.N. Kavazis, J.M. Wilson, M.D. Roberts, Effects of oral phosphatidic acid feeding with or without whey protein on muscle protein synthesis and anabolic signaling in rodent skeletal muscle, J. Int. Soc. Sports Nutr. 12 (2015) 32.
[186] Y. Ikeda, A. Murakami, H. Ohigashi, Ursolic acid: an anti- and pro-in-
flammatory triterpenoid, Mol. Nutr. Food Res. 52 (2008) 26–42.
[187] S.D. Kunkel, M. Suneja, S.M. Ebert, K.S. Bongers, D.K. Fox, S.E. Malmberg,
- F. Alipour, K. Shields, C.M. Adams, mRNA expression signatures of human skeletal muscle atrophy identify a natural compound that increases muscle mass, Cell Metab. 13 (2011) 627–638.
[188] R. Ogasawara, K. Sato, K. Higashida, K. Nakazato, S. Fujita, Ursolic acid sti-
mulates mTORC1 signaling after resistance exercise in rat skeletal muscle, Am. J. Physiol. Endocrinol. Metab. 305 (2013) E760–E765.
[189] H.S. Bang, D.Y. Seo, Y.M. Chung, K.M. Oh, J.J. Park, F. Arturo, S.H. Jeong, N. Kim,
- Han, Ursolic acid-induced elevation of serum irisin augments muscle strength during resistance training in men, Korean J. Physiol. Pharmacol. 18 (2014) 441–446.
[190] D. Church, N. Schwartz, M. Spillane, S. McKinley, T. Andre, D.S. Willoughby, A
comparison of the effects of ursolic acid and L-leucine supplementation on IGF-1 receptor and AKT-mTOR signaling in response to resistance exercise in trained men, J. Int. Soc. Sports Nutr. 11 (2014) 19.