Espero que os guste la revisión sobre el ejercicio físico en relación a metabolismo de las proteínas, basadas en diferencias como; estimulo de contracción, sexo, edad, e ingesta proteica.
Aviso legal esta obra escrita por Alejandro Ocaña García está bajo una Licencia Creative Commons Atribución-SinDerivadas 3.0 Unported.
Introducción
Por suerte la fisiología humana es tan compleja y maravillosa que dos más dos no es siempre cuatro. Durante una semana, cuando una persona cesa su entrenamiento físico pero mantiene una ingesta de comidas diarias adecuadas, (adecuada, le llamamos a una cantidad mínima de proteína 1.2-1.6 gramos de proteína por kilogramo corporal, una cantidad minima de grasas, y una cantida minima de hidratos de carbono, como no estar en déficit calórico) la masa de proteínas del músculo esquelético se mantiene esencialmente sin cambios. Este efecto se consigue por las fluctuaciones normales en la síntesis de proteína muscular, debemos de saber que el termino (MPS) se le atribuye a síntesis proteica, y el termino (MBP) a la degradación de proteínas musculares (MBP) que contribuyen a definir algebraicamente el equilibrio global neto de la proteína (NPB = MPS menos MPB) (81, 84). La alimentación y el ejercicio son estímulos potentes para MPS, que es la variable en individuos sanos que más contribuye a la NPB (91). Sin embargo, la estimulación inducida por la alimentación en la MPS es transitoria, ya que con la falta del estímulo necesario es decir, el ejercicio físico, no estaría mucho tiempo en estado anabólico. Del mismo modo, el ejercicio aeróbico y más aún el resistido (de fuerza), contribuyen a un NPB; Sin embargo, el consumo de proteínas durante la recuperación post-ejercicio es necesario para cambiar la balanza a favor en la acumulación de proteína muscular (94). Por lo tanto la alimentación y ejercicio debe ser utilizado al mismo tiempo para manifestar un NPB positivo, que en última instancia esto produciría una hipertrofia del músculo esquelético cuando se realiza habitualmente.
Los mecanismos celulares que regulan el recambio proteico muscular, los cuales incluyen la transcripción de genes, la señalización celular para iniciar la síntesis de proteínas como las enzimas que participan en diferentes vías proteolíticas, están comenzando a ser aclarados con el paso de los años (7, 27, 63, 119, 123). Estos mecanismos parecen ser muy sensibles tanto al ejercicio como a la alimentación, funcionan a través de vías separadas pero convergentes. (25, 26, 35). Un concepto general cada vez más evidente es que el ejercicio es capaz de crear una serie de procesos señalización fibrilar, en cascada, y que la alimentación es capaz de potenciar este efecto (25, 28, 38, 52). He aquí la importancia de una correcta alimentación para el deportista, cuando busca máximo rendimiento.
El enfoque de esta breve revisión estará compuesto por nuestra comprensión actual del metabolismo proteico muscular después de diferentes modalidades de contracción muscular, incluyendo tanto de tipo resistido y tipo de resistencia, como los efectos influyentes de la alimentación después del ejercicio sobre la respuesta fisiológica MPS en su relación con los seres humanos adultos y sanos, es decir sin patologías clinicas. Por otra parte, también se examinará la influencia del ejercicio y la alimentación en la señalización anabólica durante la recuperación post-ejercicio.
Ejercicio de resistencia y cambios generales en el musculo
Síntesis de proteínas
El factor anabólico del ejercicio de resistencia está bien establecido, han sido establecidas para estimular MPS entre ~ 40 y 150% por encima de los niveles basales en reposo, después de una sola sesión de entrenamiento (3, 19, 86, 87). A pesar de tan clara estimulación de MPS en el período post-ejercicio, el NPB muscular sigue siendo negativo en el estado de ayuno, debido a una elevación coincidente del MPB, una de las razones por las cuales yo no estoy a favor del ejercicio en ayunas, y más si es de tipo resistido (fuerza) (Fig. 1)
Aunque el cambio en MPB después del ejercicio de resistencia en ayunas es menor en magnitud que el cambio en MPS, este incremento obligatorio en MPB proporciona los aminoácidos necesarios para apoyar el aumento inducido por el ejercicio en MPS. El mecanismo por el cual MPB se eleva después del ejercicio en el estado de ayuno es actualmente desconocido, pero probablemente involucra una o todas de las principales vías proteolíticas (calpaínas, caspasas, lysomes, y ubiquitina-proteasoma) presentes en el músculo (63). Se postula que mientras el ayuno, eleva la MPB con el ejercicio de resistencia, a su vez limita la probabilidad del restablecimiento de aminoácidos en el sarcoplasma muscular, necesaria para proporcionar una fuente de aminoácidos y así se produzca la síntesis de proteínas miofibrilar. Esta suposición se basa en la observación del ciclo de proteína sarcoplásmico el cual se muestra una velocidad aproximadamente dos veces mayor que las proteínas miofibrilares en el estado de ayuno (22, 74).
El aumento de la MPB se atenúa y por consiguiente se convierte en un balance neto positivo cuando la disponibilidad de aminoácidos se incrementa mediante la ingesta de una fuente exógena de aminoácidos esenciales (EAA), ya sea por vía intravenosa (4) o por vía oral, después del ejercicio (Fig. 1). La magnitud y duración de los cambios en la MPS respecto al ejercicio de resistencia está relacionada en medida con el crecimiento de las proteínas musculares después del ejercicio, cuando más daño, más MPS. Sin embargo, un parámetro más importante, es el aumento agudo de la resistencia inducida por el ejercicio en la MPS, incluso en ausencia de la alimentación, se mantiene durante hasta 48 h (86), (he aquí, por qué el ir a casa corriendo, o ir a los baños del gimnasio para tomarte tu batido de proteínas rápidamente es innecesario a la par que ridículo) lo que sugiere que la alimentación en cualquier momento durante esta «ventana anabólica» debe estimular una mayor respuesta sintética de proteínas en el músculo esquelético en comparación con la alimentación en reposo (Entrada anteior) (. Fig 2).
En apoyo a esto, los datos de un estudio reciente en laboratorio demostrarón que el aumento agudo de la síntesis de proteínas muscular después de la ingestión de una dosis subóptima de proteína de suero [es decir, 15 g de proteína, o el equivalente de ~ 6 g (EAA) (22)] era mayor de 24 horas después de una serie de ejercicios de resistencia en comparación con al resto lo que sugiere el ejercicio mejora la sensibilidad de nutrientes del músculo durante un máximo de 24 h.
(Burd NA, Staples AW, Dan WD, West AD, Moore DR, Holwerda AM, Panadero SK y Phillips SM, datos no publicados); lo que indica la que la «ventana anabólica» puede ampliarse hasta 24 h después del ejercicio de resistencia; Sin embargo, parece que la alimentación temprana (1-4 horas) puede ofrecer algunas ventajas adicionales porque es cuando la MPS está estimulada en la mayor medida (43, 86, 92).
Antes de seguir, teneis que tener una idea clara, para que la creación de masa muscular o mantenimiento de la misma suceda, la tasa de síntesis proteica muscular (SPM) debe exceder a la tasa de degradación muscular MPB. El entrenamiento de resistencia o resitido (fuerza) por sí solo, aumenta de la síntesis proteica muscular, al igual que consumir una ingesta de proteína también lo hace. Por ende combinar ambas sería una estrategia perfecta para el Atleta.
El aumento de la síntesis proteica MPS muscular es mayor si se consume proteína posterior al ejercicio y se declina a las 48h subsiguientes, como he comentado anteriormente. La degradación proteica post-entreno MPB no vuelve a niveles básicos hasta pasadas 48h, cuando ingerimos alimentos, el resultado es distinto. ¿Por qué es importante conseguir el máximo estrés muscular con ejercicio? Porque a mayor degradación, mayor síntesis de proteínas.
Esto quiere decir, que por muy buena dieta e ingesta proteica que hagamos, la síntesis proteica se maximizará con el entrenamiento físico. En la siguiente imagen vemos como varía la síntesis proteica post-entreno con el tiempo, pasadas 48h sigue más elevada que en pre-entreno. Esto quiere decir que pasadas 24h después del entreno, la síntesis proteica es casi el doble que antes de entrenar. Lo ideal es hacer una ingesta proteica en las primeras 1-4 horas post entrenamiento.
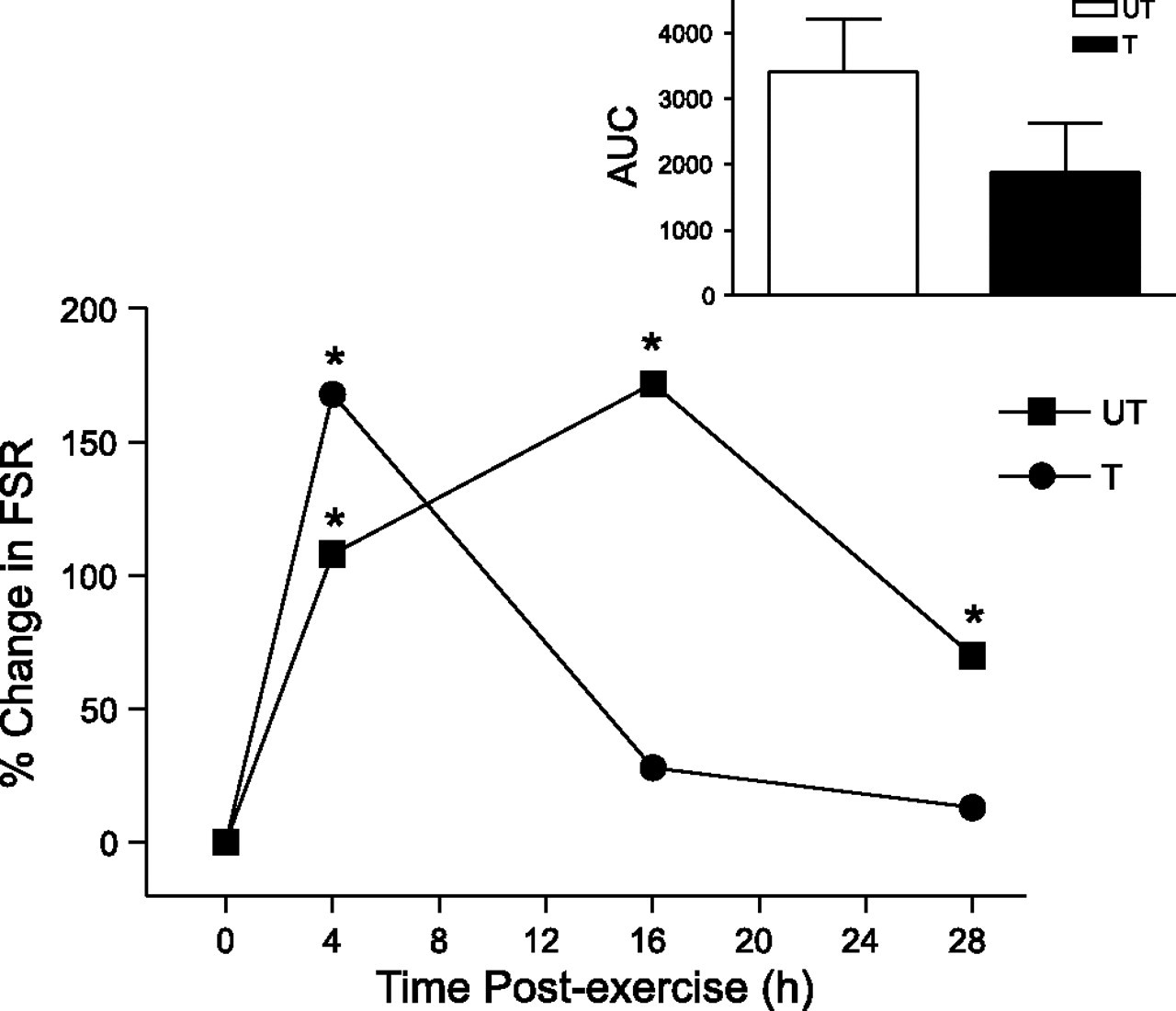
Al discutir el efecto de la alimentación hay muchas consideraciones, incluyendo la fuente de proteína (es decir, animales frente a proteínas de origen vegetal), la cantidad, el momento de la ingestión después del ejercicio, y la presencia de hidratos de carbono para estimular la liberación de insulina. Hay que destacar que en ausencia de alimentación, la MPS también puede estar influenciada por el estado de entrenamiento (Fig. 3) y / o sobrecarga de entrenamiento (intensidad, volumen, frecuencia) (20, 68, 75, 107).
Una pregunta válida es ¿cuál es el valor de los cambios a corto plazo que observamos en cuestión de horas en la predicción de un cambio crónico a largo plazo conduce a un fenotipo distinto? Existen algunas pruebas para demostrar que en estudios cuidadosamente controlados los cambios a corto plazo en MPS y MPB (124) son predictivos a los cambios a largo plazo (43). Así, los cambios agudos en el recambio proteico durante la recuperación post-ejercicio puede ser, al menos cualitativamente, predictivo de las adaptaciones crónicas a diferentes intervenciones de entrenamiento o de alimentación. Es decir, nuestros actos tendrán correlación directa al balance neto del MPS, a corto plazo.
Como he mencionado anteriormente, el estado de entrenamiento también puede afectar a la estimulación post-ejercicio de MPS. Por ejemplo,
- El carácter del entrenamiento altera la magnitud y la duración de la estimulación de la síntesis de proteínas después del ejercicio con relación a la alimentación lo que se evidencia por una mayor estimulación de la síntesis proteica (es decir, 1-4 h) la cual vuelve los niveles basales de forma más rápida (es decir, con 28 h) (Fig 3) (107).
Estos datos indican que la alimentación post-ejercicio es sumamente importante en el estado entrenado, ya que puede mejorar el tiempo de transporte de aminoácidos hacia el músculo en un momento en que las células implicadas la señalización y en la iniciación de la síntesis de proteínas es más sensible (35, 51); esta noción es parcialmente apoyada por datos que demuestran una reducción en el aumento inducido por el entrenamiento de la masa magra cuando la alimentación de la proteína se retrasa tan poco como 2 horas después del ejercicio en hombres jóvenes (43).
Los datos recientes sugieren que la respuesta de MPS para el ejercicio de resistencia se hace más «potente» con el entrenamiento físico de tal manera que los sustratos proteicos deberían estar disponibles y dirigidos preferentemente hacia la síntesis de diferentes fracciones de proteína en función del estímulo del ejercicio (48, 123). Por ejemplo, en laboratorio se ha demostrado recientemente que en los individuos no entrenados por ejemplo en el rendimiento de una serie de ejercicio de resistencia, junto con un ejercicio aeróbico, en menor medida, estimula la síntesis global de proteína (48, 123). Estos datos sugieren que una novela estímulo altera la homeostasis de tal manera que la señal a la maquinaria de síntesis de proteínas es sin refinar y enciende todas las proteínas miofibrilares musculares (y mitocondrial).Sin embargo, después del entrenamiento, la respuesta sintética aguda se vuelve más finamente sintonizada para el modo específico de ejercicio , en el que el ejercicio de resistencia preferentemente estimula la síntesis de proteínas miofibrilares, mientras que el ejercicio aeróbico estimula la síntesis de la fracción mitocondrial , he aquí la importancia de la elección del tipo de ejercicio o de estímulo, dado el objetivo del atleta o deportista (48, 123). Muchos profesionales del sector postulan que esta idea es incierta, ya que los cambios en la fosforilación de muchas proteínas de señalización comúnmente estudiadas no han mostrado una idea de apuntalamiento mecanicista de la respuesta.
Intensidad de la contracción muscular.
Una variable relativamente poco estudiada es la relación dosis-respuesta entre la intensidad de la contracción muscular y el recambio proteico. Atentos a esta parte, porque dudo mucho que haya habido muchas personas que hayan tratado este tema. Hasta la fecha, la mayoría de los estudios que han examinado los cambios en la respuesta de la síntesis de proteínas después de un programa de entrenamiento, han sido realizados con una intensidad del 70 a 80% RM a ~8-12 repeticiones (3, 19, 26, 48, 67, 86, 87, 121), debido a altas intensidades (> 70% de esfuerzo máximo) se observó, que dicho umbral de intensidad se necesita para inducir algún beneficio significativo en la masa muscular (58). Sin embargo, no se entiende completamente el efecto de las contracciones de baja intensidad en el MPS. Se ha demostrado que las intensidades de ejercicio al 20% RM, son ineficaces en la estimulación de una respuesta medible sintética de proteínas (34, 60). Curiosamente, la oclusión de la extremidad (Lectura recomendada) en esta misma intensidad, estimula la contracción del MPS (34), es decir, de esta forma podría inducir aumentos en la fuerza muscular y la hipertrofia (105, 106). ¿Cuál es entonces el mecanismo de este efecto? Sin duda es un paradigma atractivo, pienso que está relacionado con reclutamiento de unidades motoras como sus fibras musculares (es decir, el principio de tamaño). Por ejemplo, el estrés metabólico mayor (secundaria a la reducción del flujo sanguíneo) y la fatiga asociada se han mostrado que mejora la activación de las contracciones del músculo bajo fuerza, que sugiere normalmente un mayor reclutamiento de fibras tipo II ,que seguramente no se reclutó intensidades bajas de ejercicio (77). Este hallazgo puede ser importante para la estimulación post-ejercicio de MPS, porque todavía no se ha demostrado que haya mayor hipertrofia en fibras de tipo II que en fibras de tipo I (56, 115). Por lo tanto, parece digno de reconocimiento que la realización tanto de alta intensidad (> 70% RM) y de menor intensidad (30-50% RM), puede producir elevaciones similares en MPS, lo que puede traducirse en un aumento similar de la hipertrofia muscular y la masa magra. De hecho, datos recientes han demostrado que el entrenamiento de resistencia con una intensidad de sólo ~ 15% RM, de esfuerzo máximo es capaz de inducir pequeñas ganancias en el muslo área transversal (3 ± 1%), aunque inferior a los aumentos experimentados por el ejercicio de pierna formado en un 70% RM, de esfuerzo máximo (8 ± 1%) (44). Estos datos sugieren que el ejercicio de baja intensidad podría estimular un pequeño aumento en MPS post-ejercicio que es capaz de inducir la hipertrofia, partiendo del principio de que la respuesta MPS aguda es predictiva, al menos cualitativamente, proviniendo de las proteínas musculares (43, 124) Sin embargo, hay que señalar que para satisfacer el argumento de cantidad de trabajo (contracciones × carga, asumiendo el mismo rango de movimiento por contracción) realizado puede ser importante en la determinación del grado de hipertrofia muscular (39), estos investigadores equiparan trabajo total entre los de baja y alta intensidad , pues datos recientes apoyan esta tesis, de que en el entrenamiento hasta la fatiga puede ser más importante que misma intensidad de la contracción para maximizar la respuesta MPS (60).
Tipo de aminoácidos y la cantidad.
Varios estudios han demostrado que los aminoácidos EAA fisiológicamente, sólo parecen necesario para la estimulación de MPS (13, 102, 111, 113). Además, EAA parece estimular MPS de una manera dependiente de la dosis en reposo y posiblemente después del ejercicio (13, 22, 73). Para dilucidar plenamente la respuesta a la dosis de aminoácidos en la dieta, en relación con la MPS, he reunido una serie de estudios de laboratorio los cuales examinan cual es la mejor dosis para la respuesta de MPS, el que más destacó el que se realizó a cantidades crecientes de proteína (0, 5, 10, 20, y 40 g) después de ejercicio de resistencia. Los datos de este estudio indican que 20 g de proteína de la dieta intacta (la equivalente a ~8.6 g de EAA) estimulada al máximo MPS después de ejercicio de resistencia, con sólo un ligero aumento en la oxidación de aminoácidos anterior de reposo (76). Estos datos no son nada nuevos, pues estos datos se conocían ya antes (enlace de proteína) Así que, resumiendo a grandes rasgos, como ya deberíamos saber, la dosis de aminoácidos en la dieta necesaria para maximizar el anabolismo de proteínas después del ejercicio de resistencia es similar a lo que se requiere en reposo (22 gramos) o ~8-10 g de EAA, como mínimo. Lo que debemos de tener en cuenta es que hay un límite superior en la dosis útil, ojo digo ÚTIL, de proteína. En adultos jóvenes sanos es de 20-25 g (depende del peso corporal:0,25 g por kilo) Esta cantidad activa el aumento máximo en la síntesis proteica muscular tanto en reposo como post-ejercicio, pero como dije en estas anteriores entradas (aqui , aqui o aqui) no existe límite máximo de proteína en una ingesta, es decir, el cuerpo va a asimilar toda, pero eso no quiere decir que vaya a utilizar toda esa proteína para el crecimiento muscular (sintesis proteica). Hay que distinguir entre “asimilación” y “utilización”.
Asimilación: Completa
Utilización: La que determine el cuerpo necesaria para él, hasta ahora se ha demostrado que para la síntesis proteica (creación de masa muscular) unos 22-25 gramos o lo que es lo mismo 3.2- 3.4 gramos de L-Leucina se utilizaría para la masa muscular, el resto para otras funciones, como he comentado anteriormente, y como mencioné antes, el exceso (es decir lo que no utilice para la síntesis proteica, reconstrucción de tejido, órganos excétera) no podría convertirse en tejido adiposo (grasa), sino que será excretado, ya que la proteina, como sutrato energético es ineficiente.
En adultos mayores esta cantidad puede llegar a ser hasta de 40 gramos de proteína después del ejercicio.
Fuente de aminoácidos.
Una serie de estudios han identificado digestibilidad de la proteína como una variable independiente que modula el metabolismo de proteínas (8, 14, 23, 24, 33). Por ejemplo, las proteínas que se digieren rápidamente, tales como suero de leche (8, 23, 24) y la soja (14), dan lugar a una gran pero relativamente transitoria hiperaminoacidemia, (aumento de concentración de aminoácidos en sangre) y que estimula un aumento en toda la síntesis de proteína corporal. A la inversa, proteínas de digestión lenta, como la caseína (8, 23, 24) o leche (4: 1 proteína de suero de leche-caseína por contenido) (33) resultará en una hiperaminoacidemia leve y modesta que ejercerá su efecto sobre el metabolismo de proteínas principalmente mediante la inhibición de la degradación de proteínas en todo el cuerpo. (Estudio)
Con respecto al metabolismo de las proteínas del músculo, se ha demostrado que la proteína de la leche promueve mayor acreción de proteína, que la que provenga de soja, después de ejercicio de resistencia (43, 123). Por otra parte, nuestro laboratorio ha medido recientemente los valores de MPS en los hombres jóvenes consumiendo (suero de leche o caseína) o una proteína de origen vegetal (soja) después del ejercicio de resistencia (Tang JE, Moore DR, Kujbida GW, y Phillips SM, observaciones no publicadas). Los resultados indicarón que el suero estimula MPS a un mayor grado que la caseína o proteína de soja, tanto en reposo como después del ejercicio de resistencia. Aquí mi opinión es clara, para una persona ameteur o que entrena por estar sano y físicamente activo da igual la calidad de la proteína que se ingiera, pues toda cuenta, vegetal, animal etcétera. Pero para un atleta, la calidad de la misma, si sería un factor más a controlar, procurar ingerir una proteína con un aminograma completo sería lo mejor. En este caso, la proteína vegetal no se puede ni comprar con la animal, le duela a quien le duela, nunca será igual.
Los estudios han demostrado que el suero y la proteína de la leche bovina tuvieron mayor efecto sobre el MPS (síntesis proteica) que la proteína de soja a pesar de que ambos tienen la misma proteína corregida, es decir, la digestibilidad de las puntuaciones de aminoácidos (PDCAAS) por encima de 1,0. Digestibilidad de la proteína corregida aminoácidos Puntuación (PDCAAS) es un método de evaluación de la calidad de las proteínas sobre la base de ambos los requerimientos de aminoácidos de los seres humanos y su capacidad para digerirla. Si es perfectamente exacto, no, no lo es.
| Comida | PDCAAS |
| Caseina (Proteina de Leche) | 1.00 |
| Huevos | 1.00 |
| Proteina de Soja | 1.00 |
| Whey (Proteina de leche) | 1.00 |
| Carne | 0.92 |
| Granos de soja | 0.91 |
| Garbanzos | 0.78 |
| Fruta | 0.76 |
| Judias pintas | 0.75 |
| Vegetales | 0.73 |
| Cereales | 0.59 |
<
p style=»text-align:justify;»>
<
p style=»text-align:justify;»>Son incontables las investigaciones que han tratado de ver el efecto en la ingestión de diferentes tipos de fuentes proteicas, leche de vaca pura, leche de soja, suero de leche (whey protein) , en los cuales, por lo que yo he visto, siempre la animal supero la tasa de MPS (sintesis proteica) a la vegetal.
En todos, la proteina de suero de leche (whey) procedente de la leche, supera, al tipo Soy (proteína de soja) y la casein (caseina) en cuanto a tasa de aminoácidos, y síntesis proteica. Es cierto que hay algunos estudios, que mostraban valores similares de MPS, con la leche de vaca y la leche de soja, aun así, pero esto se consiguió añadiéndole una dosis de L-leucina a la leche de soja, pues hay que distinguir la leche de soja, a la proteína vegetal, pues el aminograma no es igual, que por ejemplo la alfalfa.
Aun así, con tan clara evidencia científica, no está claro en la actualidad por qué sucede de tal manera, pero se especula que esto puede ser debido a un mayor contenido de leucina en el suero de leche (whey) y la tasa de digestión rápida, al proporcionar un mayor estímulo para la MPS. Tipton y colaboradores (110) también han informado de que la proteína de suero y caseína mejoran igualmente el balance de proteina después del ejercicio, pero hallazgos recientes en laboratorio sobre la proteína láctea, específican que la caseína puede mejorar el balance neto de proteina muscular después de ejercicio de resistencia al inhibir principalmente el desglose, en un mayor grado que la proteína de suero de leche, tales como la wheyr. En conjunto, estos estudios ilustran cómo las diferencias en la disponibilidad de aminoácidos, no sólo afectan el metabolismo de proteínas en todo el cuerpo, sino también al MPS en reposo como después del ejercicio.
El momento de la ingesta de aminoácidos.
El ritmo del suministro de aminoácidos con respecto a una sesión de ejercicio puede ser una consideración importante. Tipton y sus colegas (109) no ivestigarón diferencias en la MPS con la ingestión de proteína de suero, ya sea antes o después del ejercicio. Por otra parte, Rasmussen et al. (91) observarón diferencias en MPS después del ejercicio con el consumo de proteínas, ya sea 1 o 3 horas después de la sesión de ejercicio. Aunque estos estudios indican que el ritmo del suministro de aminoácidos no parece afectar MPS en el escenario agudo, existe alguna evidencia que muestra lo contrario, respecto al entrenamiento físico crónico. Por ejemplo, retrasando la ingestión de proteínas después del ejercicio por hasta 2 h en hombres jóvenes sanos y entrenados, dio como resultado una reducción en el aumento inducido por entrenamiento en la fibra muscular y la masa magra en comparación con el consumo de proteínas inmediato (43). Además, un estudio realizado por Esmarck y colaboradores (30) demostrarón que la demora en el suministro de una bebida que contiene proteínas, carbohidratos y grasa por 2 h post-ejercicio produjo significativamente menores ganancias de fuerza en individuos de edad avanzada. Sin embargo, estos hallazgos no son universales; no hubo diferencia en el aumento de la fuerza, como tampoco en el área trasversal (un marcador relacionado con la masa muscular), o ganancias de masa magra del tejido cuando el tiempo proteína se manipula en personas mayores (17). En conjunto, estos hallazgos sugieren que un aumento en la disponibilidad de aminoácidos en la proximidad temporal cercana al estímulo ejercicio parece beneficioso e incluso puede ser necesario, especialmente en los ancianos, para apoyar adaptaciones musculares inducidos por el entrenamiento de resistencia, aun más si son crónicas. Aunque no se ha establecido después del ejercicio, se ha sugerido , para persona ancianas y como posible tratamiento sitomatico e la sarcopenia, la ingestión AAE (6,7 g), en reposo que los ancianos y asi bneficiarse de un aumento proporcional de la leucina de aminoácidos de cadena ramificada para producir una respuesta similar a la del MPS en jovenes (47). Sin embargo, si se consume la proteína adecuada, la leucina adicional no parece ser necesario (53, 55, 79, 104).
La insulina en la regulación del metabolismo de las proteínas.
La insulina es un regulador conocido del metabolismo de la proteína muscular; sin embargo, la manera en que la insulina promueve el anabolismo en el músculo esquelético esta humano sin resolver. Los datos disponibles muestran que la insulina activa varias proteínas [por ejemplo, phosphotidylinositide-3-quinasa (PI3K)] que causa la fosforilación de los factores que se sabe que juegan un papel clave en la regulación de proteínas y la síntesis de glucógeno (50). Por otra parte, la insulina se ha demostrado atenuar la proteolisis de ubiquitina (95), que se cree que es responsable de la degradación de la mayor parte de las proteínas del músculo (116), y puede también, a través de la calpaína o la activación de caspasas, degradar miofibrillas, que constituyen la mayoría de proteínas en el músculo esquelético (91).
Pocos estudios han examinado directamente el efecto de la insulina sobre el metabolismo de las proteínas con el ejercicio de resistencia. Un dado relevante, es el que, mientras el ayuno, parece que hay poco efecto adicional de la insulina sobre MPS después de ejercicio de resistencia (5, 41). Esto puede ser debido a una menor disponibilidad de aminoácidos intracelulares ya que la insulina atenúa el aumento inducido por ejercicio de resistencia en el MPB (5). Los estudios que han proporcionado los carbohidratos después del ejercicio de resistencia también han informado de una aparente atenuación de MPB, sin efecto sobre MPS (11, 54, 73). Es decir, los hidratos de carbono, se ha demostrado que no son necesarios para la sinteis proteica (MPS) crecimiento muscular, balance proteico positivo, si no que la proteina (aminocidos) seria la encargada. Pero aun asi, se ha demostrado que lo hidratos de carbono después del ejercicio de resitencia atenúan la MPB, degradación proteica aun en presencia de proteina. Por ejemplo, Borsheim et al. (12) encontraron que la provisión de una bebida que contiene 100 g de hidratos de carbono 1 h después de una serie de ejercicios de resistencia mejoró el balance proteico muscular, pero el equilibrio no se convirtió en balance positivo cuando se midió a las 3 horas después de consumir la bebida. Por lo tanto, sin un aumento en la disponibilidad de aminoácidos, el efecto antiproteolítico de la insulina sola es insuficiente para lograr la acreción de proteínas (es decir, el equilibrio positivo de proteína) después del ejercicio de resistencia no se daría.
Algunos han sugerido la pérdida de masa muscular comúnmente asociado con el proceso de envejecimiento es una relativa resistencia a la insulina, ya que esta se encarga de la captación de aminoácidos y la estimulación de MPS (118). Teniendo en cuenta los datos más recientes de Greenhaff et al. (41) que muestra la disociación entre la insulina y sus efectos, o la falta del mismo, en la síntesis de proteínas, pienso que cualquier disminución relacionada con la edad en la acción de la insulina y su mediación de aminoácido como la estimulación de MPS no es probable que sea un mecanismo directo de la insulina sobre la cinética de la proteína (41, 82). En lugar de ello, se sugiere que la insulina podría mediar cambios en el flujo microvascular (117) que probablemente se vean afectados en las personas mayores (99). Por consiguiente, el efecto sería una entrega relativamente más pobre de aminoácidos al músculo de edad avanzada y por lo tanto una respuesta sintética de proteína deficiente.
Ejercicio aerobico y cambios generales
La influencia de la resistencia al ejercicio en el recambio proteico muscular sigue siendo poco estudiada. Esto puede estar relacionado con la observación general de que tal ejercicio no suele dar lugar a un aumento significativo en el tamaño del músculo. Sin embargo, los cambios en el ejercicio de resistencia MPS siguientes son relevantes para la reparación y remodelación del tejido, así como cambios en la síntesis de fracciones de proteínas que no tienen que contribuir a una hipertrofia muscular, tales como las proteínas mitocondriales (cf. miofibrilares). Actualmente, las diferencias en el modo de ejercicio e intensidad confunden nuestra comprensión actual de cómo el ejercicio aeróbico afecta MPS y limita nuestra capacidad para hacer comparaciones entre los estudios (18, 66, 72, 112).
Los primeros estudios que examinan la respuesta aguda de MPS, consistierón en una caminata en cinta rodante en el 40% de la máxima captación del O2 en sujetos no entrenados, el cual estableció que el ejercicio de baja carga es capaz de estimular un aumento MPS (18, 97). Tipton et al. (112), sin embargo, observó que un ejercicio de alta intensidad como nadar, era incapaz de estimular una respuesta significativa en MPS en nadadoras capacitadas. Estos resultados opuestos pueden estar relacionados con el músculo implicado (vasto externo vs deltoides), el modo de realizar el ejercicio, o el nivel de entrenamiento de los sujetos, ya que hay muchas maneras de nadar, y de correr (hiit). Ciertamente, este último tiene una influencia considerable en los resultados, ya que se ha demostrado que los resultados del entrenamiento aeróbico en respuesta a la adaptación crónica provoca un aumento de las tasas de MPS basales (88, 98).
Se ha demostrado que el uso de un modelo único de ejercicio de resistencia, pomo el de patear una pierna en un ergómetro Krogh , estimula la síntesis de proteínas sarcoplásmica y miofibrilar durante 48 y 72 h, respectivamente (72). Los ejercicios de resistencia, sin embargo, no se caracteriza comúnmente por la hipertrofia del músculo esquelético, como era de esperar con un aumento tan fuerte en la síntesis de proteína miofibrilar. En laboratorio se ha examinado recientemente las respuestas específicas de las proteínas individuales (miofibrilares y mitocondrial) que residen en el músculo esquelético pos entrenamiento a un ciclo de pierna durante 45 minutos a 75% de la máxima captación de O2 en los dos estados no entrenados y capacitados. Observaron, sin importar el nivel de entrenamiento, un fuerte incremento de la síntesis de proteínas mitocondriales. Esto fue en contraste con ningún aumento la síntesis de proteínas miofibrilares (123). Por lo tanto mitocondrias y en cierta medida las proteínas saroplasmica son las proteínas que contribuyen principalmente al aumento de las MPS después de ejercico aeróbico.
Respues de la señalización celular junto a la alimentación
Los rápidos incrementos en la síntesis de proteína muscular después del ejercicio como el aumento en la disponibilidad de aminoácidos sugieren que estos cambios están mediados por mecanismos postranscripcionales (19). El ejercicio y los aminoácidos parecen estimular la síntesis de proteínas musculares a través de vías de señalización independientes pero convergentes, con la estimulación máxima de la sitensisis proteica la cual requiere cierto nivel de insulina elevada. Aunque un examen detallado del control de la transcripción está más allá del alcance de esta revisión (6, 10, 28, 49), se discutirán brevemente los pasos reguladores clave que participan en las vías de señalización que responden al ejercicio de resistencia y la alimentación. La evidencia reciente destaca la disociación entre la activación de moléculas de señalización y cambios en el MPS (41). Proponemos que cuando los estímulos son adecuados, varias moléculas de señalización [por ejemplo, (mTOR)] responden de manera cercana al ejercicio y junto a los niveles de aminoácidos; el resultado es un aumento coordinado de MPS. Sin embargo, como la insulina es permisiva para la MPS y no moduladora (41, 93), proponen que grandes aumentos en la insulina mejoran el anabólismo de la señalización en la activación molécular, pero sin aumentar aún más la MPS (. Fig 4).
El mecanismo exacto por el cual la señal de contracción del citoesqueleto de la célula, como el de la conversión de la síntesis de proteínas aún no se ha aclarado completamente. Los datos aplicados en roedores (31, 32, 40) y cultivo celular (126) sugieren que la quinasa de adhesión focal (FAK), una proteína sensible al ejercicio, es un posible vínculo en la mechanotranduction a la estimulación de la MPS. Recientemente, se ha demostrado que la fosforilación de FAK se mantiene sin cambios 6 h después de una serie aguda de ejercicio de resistencia (38). Se especuló que la fosforilación de FAK es transitoria y se produce en estrecha inmediatez del ejercicio o en respuesta a la descarga crónica (38). El apoyo a esta idea es que después de 10 semana, el FAK posphorylation fue significativamente mayor que antes del entrenamiento en humanos lo que sugieren que un estímulo crónico puede ser necesario (123).
Hasta la fecha, la subsarcolema y sus mecanismos celulares subyacentes que inician la respuesta sintética de proteínas están un poco confusos (7, 90). De hecho, la activación de los mediadores primarios de la síntesis de proteínas tales como proteína quinasa B (Akt), mTOR, proteína de unión 4E 1 (4E-BP1), 70-kDa S6 proteína quinasa (p70S6K), y la proteína ribosomal S6 (rpS6) han demostrado ser activo en la respuesta inmediata (1-4 h) después del ejercicio (21, 26, 29, 46, 56, 125). Sería de esperar, que esta respuesta sea necesaria como su activación para iniciar una respuesta en la síntesis de proteínas. Sin embargo, lo que es menos conocido, es el grado máximo de activación en los diferentes intervalos de tiempo posteriores después de una sesión de ejercicio, (es decir, a la hora, a las dos horas, etcétera). Los datos recientes en laboratorio demostraron que 6 h después del ejercicio de resistencia en estado de ayuno, la mTOR ya no es fosforilada en un grado significativo; sin embargo, su efectores p70S6K permanecierón en aumentó (38)
Una variable adicional que es poco estudiada, es la influencia del entrenamiento de resistencia de manera crónica en las vías de señalización celular. Se ha establecido que el estado físico, es decir si llevas tiempo o no, entrenando, puede influir en la medida en que se sintetizan las clases individuales de las proteínas miofibrilares musculares (o mitocondriales) (123). Por lo tanto, podría esperarse que la actividad de los factores clave de la proteína quinasas respecto al control de esta respuesta también pueden ser alterados. Se ha demostrado recientemente que después de 10 semanas de entrenamiento (es decir una formación crónica) de resistencia, la Akt, FACOR 4E (eIF4E), FAK, y glucógeno sintasa quinasa-β (β-GSK) manifiestarón un aumento en la fosforilación total en el periodo descanso, es decir después de esas 10 semanas. Además, la duración de su activación se redujo en comparación con el estado de cese del entrenamiento (123). Estos datos sugieren que 10 semanas de entrenamiento de ejercicio modifica el estado de activación de las moléculas de señalización anabólica, tal que son más fácilmente y reciptivos para iniciar la síntesis de proteínas en respuesta a los estímulos de entrenamiento. Sin embargo, la respuesta al entrenamiento crónico (8-9 años) de una disciplina particular (entrenamiento de fuerza o de resistencia) la capacitación puede ser suprimida junto con las señales anabólicas (21) y es consistente con la idea de que el ejercicio de entrenamiento es un proceso de adaptación y que un aumento del estrés de entrenamiento que se necesita para lograr mayores efectos de formación (por ejemplo, el principio de sobrecarga) (58).
Ejercicio de resistencia y señalización celular
Como hemos dicho antes, los ejercicios de resistencia activa proteínas implicadas en la regulación de MPS que son similares a aquellas en el ejercicio de fuerza (por ejemplo, mTOR) (69). Una de las adaptaciones más conocidas del ejercicio de resistencia, es un aumento en la capacidad aeróbica de músculo esquelético, que se efectúa principalmente por cambios en el contenido mitocondrial. Los cambios sintéticas específicos se producen en las mitocondrias (en lugar de la miofibrilla, como en el entrenamiento de la fuerza) estos cambios en las mitrocondrias son de particular interés en relación con el ejercicio de resistencia. Las investigaciones se han centrado en la AMP-activated proteína quinasa (AMPK) -peroxisome proliferador, ya que es la causa de la activación del receptor-γ coactivador-1α (PGC-1α), importantísima en su papel en la biogénesis mitocondrial. Se ha demostrado Ejercicio de resistencia agudo aumenta el contenido de la transcripción y el ARNm de PGC1α, un efecto que se potenció aún más con la formación (89).
Alimentación y celular de señalización
Al examinar la regulación de la síntesis de proteínas por la alimentación, los principales precursores son la hormona insulina y los aminoácidos. Destacar que la insulina, en ausencia de un aumento de los aminoácidos, no podría estimular suficiente la MPS (41). Sin embargo, la insulina funciona a través de varias vías intracelulares implicadas en la iniciación de la conversión como de la síntesis de proteínas y por lo tanto está implicado en la modulación de estas respuestas celulares. La unión a de la insulina activa su receptor PI3K, que inicia una cascada de señalización a través de Akt / proteína quinasa B (PKB). Como se discute después del ejercicio, Akt / PKB fosforila mTOR, cuyos objetivos incluyen p70S6K1, así como 4E-BP1, en última instancia conduce a la iniciación un aumento de la síntesis de proteínas.
Los aminoácidos también estimulan varias proteínas implicadas en la iniciación de la traducción, incluyendo mTOR (22), p70S6K1 (22, 64), así como 4E-BP1 (65). Sin embargo, los aminoácidos no activan PI3K o Akt / PKB, y por lo tanto la estimulación inducida por aminoácidos de mTOR deben ocurrir a través de una entrada diferente de la insulina. Sin embargo, la evidencia reciente sugiere que los aminoácidos estimulan el mTOR a través de una PI3K de clase 3, la proteína humana vacuolar de clasificación 34 (hVps34) (16, 78).
Diferencias sexuales basada en el metabolismo de proteínas
Las diferencias basadas en el sexo respecto al metabolismo proteíco son probablemente pequeña en comparación con los que a menudo se observa en los lípidos y el metabolismo de los hidratos de carbono, que si que son diferentes (96, 108). No obstante, se han realizado algunos estudios en los que hombres y mujeres en los cuales se trato de observar cualquier diferencia, demostraron que en mujeres, el metabolismo proteico es menos confiado como sustrato energético durante el ejercicio aeróbico que sus homólogos masculino (61, 62, 83). Esto quiere decir, que en el ejercicio aerobico en determinado momento depende del tiempo de la actividad, el uso de aminoácidos como sustrato energétoco, en mujeres seria menos problame en diferencia con los hombrs, en los cuales el desgaste de aminoácidos seria mayor. Un conjunto de datos también sugiere que a través del ciclo menstrual hay cambios relativamente pequeños en la cinética de la proteína, lo que indica que las diferencias agudas en los estrógenos y la progesterona que no parecen ejercer una tremenda influencia en el volumen de intercambio de las proteínas del cuerpo o músculo esquelético (70). Por otra parte, en los hombres y las mujeres, por lo menos cuando los tipos de proteínas cinéticas se normalizan a la masa magra, son prácticamente idénticos en sus tasas de rotación de proteína muscular (36).
En respuesta al ejercicio de alimentación y la resistencia, los hombres y las mujeres jóvenes parecen responder de manera cualitativa y cuantitativamente similares ya que los estudios en los que se han utilizado los hombres y las mujeres como sujetos pueden mostrar poca diferencia entre los dos sexos (26, 92, 114).Sin embargo, hasta la fecha y hasta donde sabemos, no hay comparación sistemática para examinar sus repsuesta respecto al sexo, a alimentar solo o a ambos o como el ejercicio de resistencia solo o en combinación con la alimentación. Sin embargo, si examinamos los datos mirando adaptaciones crónicas al ejercicio de resistencia en los hombres y las mujeres, los datos sugieren que mientras que existen diferencias cuantitativas en la hipertrofia y el aumento del músculo, los cambios son similares (1, 45, 57). Así que, las mujeres jóvenes tienen la capacidad a la hipertrofia de sus fibras musculares en respuesta al entrenamiento de resistencia (103, 120), a pesar de su 10 veces menor de concentración de testosterona que los hombres, pues los mecanismos son dominante en la promoción de aumentos en MPS y fibra hipertrofia.
Existe cierta evidencia que sugiere que los tendones de las mujeres tienen un potencial menor capacidad de adaptación en respuesta al ejercicio (71, 122). Curiosamente, esta menor capacidad de adaptación en el tendón puede ser exacerbada por el uso de anticonceptivos orales (42). Dado que las mujeres sufren un mayor número de cepas de ligamentos y tendones que los hombres, esto claramente es un área de investigación única en diferencias basadas en el sexo.
Aunque los hombres y las mujeres jóvenes pueden mostrar poca diferencia en el volumen de intercambio de proteínas, la situación parece ser diferente para los hombres y las mujeres de más edad, donde se han reportado diferencias basales en MPS (101). Quizás lo más importante, es que las mujeres mayores también demostrarón una incapacidad para aumentar MPS en respuesta a una alimentación de proteína (101). También se demostró que las mujeres mayores tienen una capacidad reducida para la hipertrofia en respuesta a ejercicios de resistencia (2, 15, 57). Datos no publicados recientes, corroboran la idea de que el potencial hipertrófico se altera en las mujeres mayores, también podría indicar que las mujeres de más edad muestran un aumento menor en MPS en respuesta a ejercicios de resistencia que los hombres (100). Una reducción de la capacidad de respuesta de las señales anabólicas podría ser la razón de estos cambios (37, 80, 101); Sin embargo, se requiere más investigación para decir definitivamente cómo el envejecimiento y el sexo interactúan con el anabolismo y su relación con la alimentación y el ejercicio de resistencia.
Importancia y perspectivas
En los últimos años, nuestra comprensión general de la regulación del metabolismo de la proteína del músculo en el ejercicio y la recuperación se ha convertido en el foco más importante. Cada vez es más evidente que la respuesta MPS está muy regulada y que la magnitud de la respuesta puede ser manipulada por múltiples factores relacionados tanto con el propio ejercicio, así como la nutrición. Diferencias basadas en el sexo respecto al recambio de proteínas relacionadas con el ejercicio parecen existir en hombres y mujeres jóvenes, pero estas diferencias son relativamente menores. Por el contrario, las mujeres mayores pueden desarrollar una resistencia anabólica a la alimentación y el ejercicio, no se conoce la causa al porque se crea tal resistencia. La resolución de las respuestas de las subfracciones de proteína muscular específica (es decir, miofibrilar, mitocondrial, y sarcoplásmico) en el futuro, generaran conocimientos sobre diferentes perturbaciones de ejercicio y cómo éstos conducen a diversas adaptaciones musculares como los cambios fenotípicos asociados con la plasticidad del músculo esquelético.
Hay algunas lagunas en la investigación, por ejemplo, en los seres humanos una disociación entre las proteínas de señalización que regulan la iniciación de la síntesis de proteínas como medición directamente a las EOD (41). Es probable que las modificaciones de la señalización moleculares que regulan MPS después del ejercicio se producen muy rápidamente. Por lo tanto se requiere un transcurso de tiempo detallado en la respuesta de las proteínas de señalización y el músculo en el período post-ejercicio. Actualmente, la mayoría de los datos han sido reportados por un solo punto en el tiempo post-ejercicio (3-5, 48, 85, 87, 115). Propongo que los diferentes mecanismos establecidos para el aumento de los MPS en momentos posteriores (es decir, 24 a 72 horas) (72, 86), la cual es necesaria para conducir la remodelación muscular y las adaptaciones sucesivas al estímulo del ejerciciom, como el crecimiento muscular o la recuperación del tejido dañado tras el ejercicio físico. Como tal, los estudios en los que se examinarón el metabolismo de las proteínas en los períodos posteriores al ejercicio 1-4 horas (posterior), garantizan un aumento del MPS, mucho mayor que sin la ingesta de proteína en dicho intervalo de tiempo, sin importancia del tipo de contracción realizada. Con todo esto, cabe destacar que la mayoría de los estudios sobre el metabolismo de la proteína muscular que investigan los efectos de la nutrición y el ejercicio se llevarón a cabo bajo condiciones muy controladas para ayudar a delinear las respuestas mecánicas específicas a diferentes intervenciones y por lo tanto pueden ser erróneos al aplicarlo a toda persona común. Estas investigaciones suelen emplear modelos de ejercicios no prescritos comúnmente y / o utilizados durante la práctica cotidiana, por aquellos monitores de gimnasio. Sin embargo, estos estudios proporcionan el marco científico obligatorio para saber más sobre estas intervenciones nutricionales o del de ejercicio, ya que posteriormente pueden ser prescritos para diferentes poblaciones y aplicarlos de una manera más real. Por último, aunque no es una variable general, los cambios en la degradación de proteínas después del ejercicio (especialmente en el período de tiempo de 24 a 72-h) han sido poco estudiados. Las deficiencias metodológicas para medir la velocidad de descomposición fraccional, (una medida directa de la degradación de proteínas muscular), en el músculo esquelético impide en gran medida su capacidad para ser utilizado en el estado alimentado y por lo tanto está dejando una comprensión incompleta de recambio proteico muscular después del ejercicio, por lo que no se puede obtener conclusuiones claras en este ultimo aspecto.
Espero que os haya entretenido la revisión sobre el ejercicio físico en relación a metabolismo de las proteínas, basadas en diferencias como; estimulo de contracción, sexo, edad, e ingesta proteica.
REFERENCES
Abe T, DeHoyos DV, Pollock ML, Garzarella L. Time course for strength and muscle thickness changes following upper and lower body resistance training in men and women. Eur J Appl Physiol 81:174–180, 2000.
Bamman MM, Hill VJ, Adams GR, Haddad F, Wetzstein CJ, Gower BA, Ahmed A, Hunter GR.Gender differences in resistance-training-induced myofiber hypertrophy among older adults. J Gerontol A Biol Sci Med Sci 58: 108–116, 2003.
Biolo G, Maggi SP, Williams BD, Tipton KD, Wolfe RR. Increased rates of muscle protein turnover and amino acid transport after resistance exercise in humans. Am J Physiol Endocrinol Metab 268: E514–E520, 1995.
Biolo G, Tipton KD, Klein S, Wolfe RR. An abundant supply of amino acids enhances the metabolic effect of exercise on muscle protein. Am J Physiol Endocrinol Metab 273: E122–E129, 1997.
Biolo G, Williams BD, Fleming RY, Wolfe RR. Insulin action on muscle protein kinetics and amino acid transport during recovery after resistance exercise. Diabetes 48: 949–957, 1999.
Blomstrand E, Eliasson J, Karlsson HK, Kohnke R. Branched-chain amino acids activate key enzymes in protein synthesis after physical exercise. J Nutr 136: 269S–273S, 2006.
Bodine SC. mTOR signaling and the molecular adaptation to resistance exercise. Med Sci Sports Exerc 38: 1950–1957, 2006.
Boirie Y, Dangin M, Gachon P, Vasson MP, Maubois JL, Beaufrere B. Slow and fast dietary proteins differently modulate postprandial protein accretion. Proc Natl Acad Sci USA 94: 14930–14935,1997.
Bolster DR, Jefferson LS, Kimball SR. Regulation of protein synthesis associated with skeletal muscle hypertrophy by insulin-, amino acid- and exercise-induced signalling. Proc Nutr Soc 63: 351–356,2004.
Bolster DR, Vary TC, Kimball SR, Jefferson LS. Leucine regulates translation initiation in rat skeletal muscle via enhanced eIF4G phosphorylation. J Nutr 134: 1704–1710, 2004.
Borsheim E, Aarsland A, Wolfe RR. Effect of an amino acid, protein, and carbohydrate mixture on net muscle protein balance after resistance exercise. Int J Sport Nutr Exerc Metab 14: 255–271, 2004.
Borsheim E, Cree MG, Tipton KD, Elliott TA, Aarsland A, Wolfe RR. Effect of carbohydrate intake on net muscle protein synthesis during recovery from resistance exercise. J Appl Physiol 96: 674–678,2004.
Borsheim E, Tipton KD, Wolf SE, Wolfe RR. Essential amino acids and muscle protein recovery from resistance exercise. Am J Physiol Endocrinol Metab 283: E648–E657, 2002.
Bos C, Metges CC, Gaudichon C, Petzke KJ, Pueyo ME, Morens C, Everwand J, Benamouzig R, Tome D. Postprandial kinetics of dietary amino acids are the main determinant of their metabolism after soy or milk protein ingestion in humans. J Nutr 133: 1308–1315, 2003.
Brose A, Parise G, Tarnopolsky MA. Creatine supplementation enhances isometric strength and body composition improvements following strength exercise training in older adults. J Gerontol A Biol Sci Med Sci 58: 11–19, 2003.
Byfield MP, Murray JT, Backer JM. hVps34 is a nutrient-regulated lipid kinase required for activation of p70 S6 kinase. J Biol Chem 280: 33076–33082, 2005.
Candow DG, Chilibeck PD, Facci M, Abeysekara S, Zello GA. Protein supplementation before and after resistance training in older men. Eur J Appl Physiol 97: 548–556, 2006.
Carraro F, Stuart CA, Hartl WH, Rosenblatt J, Wolfe RR. Effect of exercise and recovery on muscle protein synthesis in human subjects. Am J Physiol Endocrinol Metab 259: E470–E476, 1990.
Chesley A, MacDougall JD, Tarnopolsky MA, Atkinson SA, Smith K. Changes in human muscle protein synthesis after resistance exercise. J Appl Physiol 73: 1383–1388, 1992.
Coffey VG, Reeder DW, Lancaster GI, Yeo WK, Febbraio MA, Yaspelkis BB 3rd, Hawley JA.Effect of high-frequency resistance exercise on adaptive responses in skeletal muscle. Med Sci Sports Exerc 39: 2135–2144, 2007.
Coffey VG, Zhong Z, Shield A, Canny BJ, Chibalin AV, Zierath JR, Hawley JA. Early signaling responses to divergent exercise stimuli in skeletal muscle from well-trained humans. FASEB J 20: 190–192, 2006.
Cuthbertson D, Smith K, Babraj J, Leese G, Waddell T, Atherton P, Wackerhage H, Taylor PM, Rennie MJ. Anabolic signaling deficits underlie amino acid resistance of wasting, aging muscle.FASEB J 19: 422–424, 2005.
Dangin M, Boirie Y, Garcia-Rodenas C, Gachon P, Fauquant J, Callier P, Ballevre O, Beaufrere B. The digestion rate of protein is an independent regulating factor of postprandial protein retention. Am J Physiol Endocrinol Metab 280: E340–E348, 2001.
Dangin M, Guillet C, Garcia-Rodenas C, Gachon P, Bouteloup-Demange C, Reiffers-Magnani K, Fauquant J, Ballevre O, Beaufrere B. The rate of protein digestion affects protein gain differently during aging in humans. J Physiol 549: 635–644, 2003.
Dreyer HC, Drummond MJ, Pennings B, Fujita S, Glynn EL, Chinkes DL, Dhanani S, Volpi E, Rasmussen BB. Leucine-enriched essential amino acid and carbohydrate ingestion following resistance exercise enhances mTOR signaling and protein synthesis in human muscle. Am J Physiol Endocrinol Metab 294: E392–E400, 2008.
Dreyer HC, Fujita S, Cadenas JG, Chinkes DL, Volpi E, Rasmussen BB. Resistance exercise increases AMPK activity and reduces 4E-BP1 phosphorylation and protein synthesis in human skeletal muscle. J Physiol 576: 613–624, 2006.
Drummond MJ, Miyazaki M, Dreyer HC, Pennings B, Dhanani S, Volpi E, Esser KA, Rasmussen BB. Expression of growth-related genes in young and old human skeletal muscle following an acute stimulation of protein synthesis. J Appl Physiol (September 11 2008). doi:10.1152/japplphysiol.90842.2008.
Drummond MJ, Rasmussen BB. Leucine-enriched nutrients and the regulation of mammalian target of rapamycin signalling and human skeletal muscle protein synthesis. Curr Opin Clin Nutr Met Care 11:222–226, 2008.
Eliasson J, Elfegoun T, Nilsson J, Kohnke R, Ekblom B, Blomstrand E. Maximal lengthening contractions increase p70 S6 kinase phosphorylation in human skeletal muscle in the absence of Nutral supply. Am J Physiol Endocrinol Metab 291: E1197–E1205, 2006.
Esmarck B, Andersen JL, Olsen S, Richter EA, Mizuno M, Kjaer M. Timing of postexercise protein intake is important for muscle hypertrophy with resistance training in elderly humans. J Physiol535: 301–311, 2001.
Fluck M, Carson JA, Gordon SE, Ziemiecki A, Booth FW. Focal adhesion proteins FAK and paxillin increase in hypertrophied skeletal muscle. Am J Physiol Cell Physiol 277: C152–C162, 1999.
Fluck M, Ziemiecki A, Billeter R, Muntener M. Fibre-type specific concentration of focal adhesion kinase at the sarcolemma: influence of fibre innervation and regeneration. J Exp Biol 205: 2337–2348,2002.
Fouillet H, Mariotti F, Gaudichon C, Bos C, Tome D. Peripheral and splanchnic metabolism of dietary nitrogen are differently affected by the protein source in humans as assessed by compartmental modeling. J Nutr 132: 125–133, 2002.
Fujita S, Abe T, Drummond MJ, Cadenas JG, Dreyer HC, Sato Y, Volpi E, Rasmussen BB.Blood flow restriction during low-intensity resistance exercise increases S6K1 phosphorylation and muscle protein synthesis. J Appl Physiol 103: 903–910, 2007.
Fujita S, Dreyer HC, Drummond MJ, Glynn EL, Cadenas JG, Yoshizawa F, Volpi E, Rasmussen BB. Nutrient signalling in the regulation of human muscle protein synthesis. J Physiol 582:813–823, 2007.
Fujita S, Rasmussen BB, Bell JA, Cadenas JG, Volpi E. Basal muscle intracellular amino acid kinetics in women and men. Am J Physiol Endocrinol Metab 292: E77–E83, 2007.
Funai K, Parkington JD, Carambula S, Fielding RA. Age-associated decrease in contraction-induced activation of downstream targets of Akt/mTor signaling in skeletal muscle. Am J Physiol Regul Integr Comp Physiol 290: R1080–R1086, 2006.
Glover EI, Oates BR, Tang JE, Moore DR, Tarnopolsky MA, Phillips SM. Resistance exercise decreases eIF2Bε phosphorylation and potentiates the feeding-induced stimulation of p70S6K1 and rpS6 in young men. Am J Physiol Regul Integr Comp Physiol 295: R604–R610, 2008.
Goldspink G, Howells KF. Work-induced hypertrophy in exercised normal muscles of different ages and the reversibility of hypertrophy after cessation of exercise. J Physiol 239: 179–193, 1974.
Gordon SE, Fluck M, Booth FW. Selected Contribution: Skeletal muscle focal adhesion kinase, paxillin, and serum response factor are loading dependent. J Appl Physiol 90: 1174–1183, 2001.
Greenhaff PL, Karagounis L, Peirce N, Simpson EJ, Hazell M, Layfield R, Wackerhage H, Smith K, Atherton P, Selby A, Rennie MJ. Disassociation between the effects of amino acids and insulin on signaling, ubiquitin-ligases, and protein turnover in human muscle. Am J Physiol Endocrinol Metab 295:E595–E604, 2008.
Hansen M, Koskinen SO, Petersen SG, Doessing S, Frystyk J, Flyvbjerg A, Westh E, Magnusson SP, Kjaer M, Langberg H. Ethinyl oestradiol administration in women suppresses synthesis of collagen in tendon in response to exercise. J Physiol 586: 3005–3016, 2008.
Hartman JW, Tang JE, Wilkinson SB, Tarnopolsky MA, Lawrence RL, Fullerton AV, Phillips SM. Consumption of fat-free fluid milk after resistance exercise promotes greater lean mass accretion than does consumption of soy or carbohydrate in young, novice, male weightlifters. Am J Clin Nutr 86: 373–381,2007.
Holm L, Reitelseder S, Pedersen TG, Doessing S, Petersen SG, Flyvbjerg A, Andersen JL, Aagaard P, Kjaer M. Changes in muscle size and MHC composition in response to resistance exercise with heavy and light loading intensity. J Appl Physiol 105: 1454–1461, 2008.
Hubal MJ, Gordish-Dressman H, Thompson PD, Price TB, Hoffman EP, Angelopoulos TJ, Gordon PM, Moyna NM, Pescatello LS, Visich PS, Zoeller RF, Seip RL, Clarkson PM. Variability in muscle size and strength gain after unilateral resistance training. Med Sci Sports Exerc 37: 964–972, 2005.
Karlsson HK, Nilsson PA, Nilsson J, Chibalin AV, Zierath JR, Blomstrand E. Branched-chain amino acids increase p70S6k phosphorylation in human skeletal muscle after resistance exercise. Am J Physiol Endocrinol Metab 287: E1–E7, 2004.
Katsanos CS, Kobayashi H, Sheffield-Moore M, Aarsland A, Wolfe RR. A high proportion of leucine is required for optimal stimulation of the rate of muscle protein synthesis by essential amino acids in the elderly. Am J Physiol Endocrinol Metab 291: E381–E387, 2006.
Kim PL, Staron RS, Phillips SM. Fasted-state skeletal muscle protein synthesis after resistance exercise is altered with training. J Physiol 568: 283–290, 2005.
Kimball SR, Jefferson LS. Signaling pathways and molecular mechanisms through which branched-chain amino acids mediate translational control of protein synthesis. J Nutr 136: 227S–231S, 2006.
Kimball SR, Vary TC, Jefferson LS. Regulation of protein synthesis by insulin. Annu Rev Physiol56: 321–348, 1994.
Koopman R, Pennings B, Zorenc AH, van Loon LJ. Protein ingestion further augments S6K1 phosphorylation in skeletal muscle following resistance type exercise in males. J Nutr 137: 1880–1886,2007.
Koopman R, Saris WH, Wagenmakers AJ, van Loon LJ. Nutral interventions to promote post-exercise muscle protein synthesis. Sports Med (Auckland, NZ) 37: 895–906, 2007.
Koopman R, Verdijk L, Manders RJ, Gijsen AP, Gorselink M, Pijpers E, Wagenmakers AJ, van Loon LJ. Co-ingestion of protein and leucine stimulates muscle protein synthesis rates to the same extent in young and elderly lean men. Am J Clin Nutr 84: 623–632, 2006.
Koopman R, Verdijk LB, Beelen M, Gorselink M, Kruseman AN, Wagenmakers AJ, Kuipers H, van Loon LJ. Co-ingestion of leucine with protein does not further augment postexercise muscle protein synthesis rates in elderly men. Br J Nutr 94: 1–10, 2008.
Koopman R, Verdijk LB, Beelen M, Gorselink M, Kruseman AN, Wagenmakers AJ, Kuipers H, van Loon LJ. Co-ingestion of leucine with protein does not further augment post-exercise muscle protein synthesis rates in elderly men. Br J Nutr 99: 571–580, 2008.
Koopman R, Zorenc AH, Gransier RJ, Cameron-Smith D, van Loon LJ. Increase in S6K1 phosphorylation in human skeletal muscle following resistance exercise occurs mainly in type II muscle fibers. Am J Physiol Endocrinol Metab 290: E1245–E1252, 2006.
Kosek DJ, Kim JS, Petrella JK, Cross JM, Bamman MM. Efficacy of 3 days/wk resistance training on myofiber hypertrophy and myogenic mechanisms in young vs. older adults. J Appl Physiol 101: 531–544, 2006.
Kraemer WJ, Ratamess NA. Fundamentals of resistance training: progression and exercise prescription. Med Sci Sports Exerc 36: 674–688, 2004.
Kumar V, Selby A, Rankin D, Patel R, Atherton P, Hildebrandt W, Williams J, Smith K, Seynnes O, Hiscock N, Rennie MJ. Age-related differences in dose response of muscle protein synthesis to resistance exercise in young and old men. J Physiol 587: 211–217, 2008.
Lamont LS, McCullough AJ, Kalhan SC. Gender differences in leucine, but not lysine, kinetics. J Appl Physiol 91: 357–362, 2001.
Lamont LS, McCullough AJ, Kalhan SC. Gender differences in the regulation of amino acid metabolism. J Appl Physiol 95: 1259–1265, 2003.
Lecker SH, Solomon V, Mitch WE, Goldberg AL. Muscle protein breakdown and the critical role of the ubiquitin-proteasome pathway in normal and disease states. J Nutr 129: 227S–237S, 1999.
Liu Z, Jahn LA, Long W, Fryburg DA, Wei L, Barrett EJ. Branched chain amino acids activate messenger ribonucleic acid translation regulatory proteins in human skeletal muscle, and glucocorticoids blunt this action. J Clin Endocrinol Metab 86: 2136–2143, 2001.
Liu Z, Jahn LA, Wei L, Long W, Barrett EJ. Amino acids stimulate translation initiation and protein synthesis through an Akt-independent pathway in human skeletal muscle. J Clin Endocrinol Metab 87:5553–5558, 2002.
Ma K, Mallidis C, Bhasin S, Mahabadi V, Artaza J, Gonzalez-Cadavid N, Arias J, Salehian B.Glucocorticoid-induced skeletal muscle atrophy is associated with upregulation of myostatin gene expression. Am J Physiol Endocrinol Metab 285: E363–E371, 2003.
MacDougall JD, Gibala MJ, Tarnopolsky MA, MacDonald JR, Interisano SA, Yarasheski KE.The time course for elevated muscle protein synthesis following heavy resistance exercise. Can J Appl Physiol 20: 480–486, 1995.
MacDougall JD, Tarnopolsky MA, Chesley A, Atkinson SA. Changes in muscle protein synthesis following heavy resistance exercise in humans: a pilot study. Acta Physiol Scand 146: 403–404, 1992.
Mascher H, Andersson H, Nilsson PA, Ekblom B, Blomstrand E. Changes in signaling pathways regulating protein synthesis in human muscle in the recovery period after endurance exercise. Acta Physiol (Oxford, England) 191: 67–75, 2007.
Miller BF, Hansen M, Olesen JL, Flyvbjerg A, Schwarz P, Babraj JA, Smith K, Rennie MJ, Kjaer M. No effect of menstrual cycle on myofibrillar and connective tissue protein synthesis in contracting skeletal muscle. Am J Physiol Endocrinol Metab 290: E163–E168, 2006.
Miller BF, Hansen M, Olesen JL, Schwarz P, Babraj JA, Smith K, Rennie MJ, Kjaer M. Tendon collagen synthesis at rest and after exercise in women. J Appl Physiol 102: 541–546, 2007.
Miller BF, Olesen JL, Hansen M, Dossing S, Crameri RM, Welling RJ, Langberg H, Flyvbjerg A, Kjaer M, Babraj JA, Smith K, Rennie MJ. Coordinated collagen and muscle protein synthesis in human patella tendon and quadriceps muscle after exercise. J Physiol 567: 1021–1033, 2005.
Miller SL, Tipton KD, Chinkes DL, Wolf SE, Wolfe RR. Independent and combined effects of amino acids and glucose after resistance exercise. Med Sci Sports Exerc 35: 449–455, 2003.
Mittendorfer B, Andersen JL, Plomgaard P, Saltin B, Babraj JA, Smith K, Rennie MJ. Protein synthesis rates in human muscles: neither anatomical location nor fibre-type composition are major determinants. J Physiol 563: 203–211, 2005.
Moore DR, Phillips SM, Babraj JA, Smith K, Rennie MJ. Myofibrillar and collagen protein synthesis in human skeletal muscle in young men after maximal shortening and lengthening contractions.Am J Physiol Endocrinol Metab 288: E1153–E1159, 2005.
Moore DR, Robinson MJ, Fry JL, Tang JE, Glover EI, Wilkinson SB, Prior T, Tarnopolsky MA, Phillips SM. Ingested protein dose-response of muscle and alumin protein synthesis after resistance exercise in young men. Am J Clinical Nutr in press.
Moritani T, Sherman WM, Shibata M, Matsumoto T, Shinohara M. Oxygen availability and motor unit activity in humans. Eur J Appl Physiol 64: 552–556, 1992.
Nobukuni T, Joaquin M, Roccio M, Dann SG, Kim SY, Gulati P, Byfield MP, Backer JM, Natt F, Bos JL, Zwartkruis FJ, Thomas G. Amino acids mediate mTOR/raptor signaling through activation of class 3 phosphatidylinositol 3OH-kinase. Proceedings of the Natl Acad Sci USA 102: 14238–14243, 2005.
Paddon-Jones D, Sheffield-Moore M, Zhang XJ, Volpi E, Wolf SE, Aarsland A, Ferrando AA, Wolfe RR. Amino acid ingestion improves muscle protein synthesis in the young and elderly. Am J Physiol Endocrinol Metab 286: E321–E328, 2004.
Parkington JD, LeBrasseur NK, Siebert AP, Fielding RA. Contraction-mediated mTOR, p70S6k, and ERK1/2 phosphorylation in aged skeletal muscle. J Appl Physiol 97: 243–248, 2004.
Phillips SM. Dietary protein for athletes: from requirements to metabolic advantage. Appl Physiol Nutr Metab 31: 647–654, 2006.
Phillips SM. Insulin and muscle protein turnover in humans: stimulatory, permissive, inhibitory, or all of the above? Am J Physiol Endocrinol Metab 295: E731, 2008.
Phillips SM, Atkinson SA, Tarnopolsky MA, MacDougall JD. Gender differences in leucine kinetics and nitrogen balance in endurance athletes. J Appl Physiol 75: 2134–2141, 1993.
Phillips SM, Hartman JW, Wilkinson SB. Dietary protein to support anabolism with resistance exercise in young men. J Am Coll Nutr 24: 134S–139S, 2005.
Phillips SM, Parise G, Roy BD, Tipton KD, Wolfe RR, Tarnopolsky MA. Resistance training-induced adaptations in skeletal muscle protein turnover in the fed state. Can J Physiol Pharmacol 80:1045–1053, 2002.
Phillips SM, Tipton KD, Aarsland A, Wolf SE, Wolfe RR. Mixed muscle protein synthesis and breakdown after resistance exercise in humans. Am J Physiol Endocrinol Metab 273: E99–E107, 1997.
Phillips SM, Tipton KD, Ferrando AA, Wolfe RR. Resistance training reduces the acute exercise-induced increase in muscle protein turnover. Am J Physiol Endocrinol Metab 276: E118–E124, 1999.
Pikosky MA, Gaine PC, Martin WF, Grabarz KC, Ferrando AA, Wolfe RR, Rodriguez NR.Aerobic exercise training increases skeletal muscle protein turnover in healthy adults at rest. J Nutr 136:379–383, 2006.
Pilegaard H, Saltin B, Neufer PD. Effect of short-term fasting and refeeding on transcriptional regulation of metabolic genes in human skeletal muscle. Diabetes 52: 657–662, 2003.
Proud CG. Signalling to translation: how signal transduction pathways control the protein synthetic machinery. Biochem J 403: 217–234, 2007.
Rasmussen BB, Phillips SM. Contractile and nutral regulation of human muscle growth. Exerc Sport Sci Rev 31: 127–131, 2003.
Rasmussen BB, Tipton KD, Miller SL, Wolf SE, Wolfe RR. An oral essential amino acid-carbohydrate supplement enhances muscle protein anabolism after resistance exercise. J Appl Physiol 88:386–392, 2000.
Rennie MJ. Control of muscle protein synthesis as a result of contractile activity and amino acid availability: implications for protein requirements. Int J Sport Nutr Exerc Metab 11, Suppl: S170–S176,2001.
Rennie MJ, Wackerhage H, Spangenburg EE, Booth FW. Control of the size of the human muscle mass. Annu Rev Physiol 66: 799–828, 2004.
Roberts RG, Redfern CP, Goodship TH. Effect of insulin upon protein degradation in cultured human myocytes. Eur J Clinical Invest 33: 861–867, 2003.
Roepstorff C, Donsmark M, Thiele M, Vistisen B, Stewart G, Vissing K, Schjerling P, Hardie DG, Galbo H, Kiens B. Sex differences in hormone-sensitive lipase expression, activity, and phosphorylation in skeletal muscle at rest and during exercise. Am J Physiol Endocrinol Metab 291:E1106–E1114, 2006.
Sheffield-Moore M, Yeckel CW, Volpi E, Wolf SE, Morio B, Chinkes DL, Paddon-Jones D, Wolfe RR. Postexercise protein metabolism in older and younger men following moderate-intensity aerobic exercise. Am J Physiol Endocrinol Metab 287: E513–E522, 2004.
Short KR, Vittone JL, Bigelow ML, Proctor DN, Nair KS. Age and aerobic exercise training effects on whole body and muscle protein metabolism. Am J Physiol Endocrinol Metab 286: E92–E101, 2004.
Skilton MR, Lai NT, Griffiths KA, Molyneaux LM, Yue DK, Sullivan DR, Celermajer DS. Meal-related increases in vascular reactivity are impaired in older and diabetic adults: insights into roles of aging and insulin in vascular flow. Am J Physiol Heart Circ Physiol 288: H1404–H1410, 2005.
Smith G, Villareal DT, Sinacore D, Shah K, Mittendorfer B. The anabolic response to exercise training is greater in older men than older women. In: 2008 APS Conference. The Integrative Biology of Exercise-V. September 24–27, 2008, Hilton Head, South Carolina. Section: Gender differences. Abstract no. 17.2, p. 42.
Smith GI, Atherton P, Villareal DT, Frimel TN, Rankin D, Rennie MJ, Mittendorfer B.Differences in muscle protein synthesis and anabolic signaling in the postabsorptive state and in response to food in 65–80 year old men and women. PLoS ONE 3: e1875, 2008.
Smith K, Reynolds N, Downie S, Patel A, Rennie MJ. Effects of flooding amino acids on incorporation of labeled amino acids into human muscle protein. Am J Physiol Endocrinol Metab 275: E73–E78, 1998.
Staron RS, Malicky ES, Leonardi MJ, Falkel JE, Hagerman FC, Dudley GA. Muscle hypertrophy and fast fiber type conversions in heavy resistance-trained women. Eur J Appl Physiol 60: 71–79, 1990.
Symons TB, Schutzler SE, Cocke TL, Chinkes DL, Wolfe RR, Paddon-Jones D Aging does not impair the anabolic response to a protein-rich meal. Am J Clin Nutr 86: 451–456, 2007.
Takarada Y, Sato Y, Ishii N. Effects of resistance exercise combined with vascular occlusion on muscle function in athletes. Eur J Appl Physiol 86: 308–314, 2002.
Takarada Y, Takazawa H, Sato Y, Takebayashi S, Tanaka Y, Ishii N. Effects of resistance exercise combined with moderate vascular occlusion on muscular function in humans. J Appl Physiol 88:2097–2106, 2000.
Tang JE, Perco JG, Moore DR, Wilkinson SB, Phillips SM. Resistance training alters the response of fed state mixed muscle protein synthesis in young men. Am J Physiol Regul Integr Comp Physiol 294: R172–R178, 2008.
Tarnopolsky MA. Sex differences in exercise metabolism and the role of 17-beta estradiol. Med Sci Sports Exerc 40: 648–654, 2008.
Tipton KD, Elliott TA, Cree MG, Aarsland AA, Sanford AP, Wolfe RR. Stimulation of net muscle protein synthesis by whey protein ingestion before and after exercise. Am J Physiol Endocrinol Metab 292:E71–E76, 2007.
Tipton KD, Elliott TA, Cree MG, Wolf SE, Sanford AP, Wolfe RR. Ingestion of casein and whey proteins result in muscle anabolism after resistance exercise. Med Sci Sports Exerc 36: 2073–2081, 2004.
Tipton KD, Ferrando AA, Phillips SM, Doyle D Jr, Wolfe RR. Postexercise net protein synthesis in human muscle from orally administered amino acids. Am J Physiol Endocrinol Metab 276: E628–E634,1999.
Tipton KD, Ferrando AA, Williams BD, Wolfe RR. Muscle protein metabolism in female swimmers after a combination of resistance and endurance exercise. J Appl Physiol 81: 2034–2038, 1996.
Tipton KD, Gurkin BE, Matin S, Wolfe RR. Nonessential amino acids are not necessary to stimulate net muscle protein synthesis in healthy volunteers. J Nutr Biochem 10: 89–95, 1999.
Tipton KD, Rasmussen BB, Miller SL, Wolf SE, Owens-Stovall SK, Petrini BE, Wolfe RR.Timing of amino acid-carbohydrate ingestion alters anabolic response of muscle to resistance exercise. Am J Physiol Endocrinol Metab 281: E197–E206, 2001.
Trappe TA, Raue U, Tesch PA. Human soleus muscle protein synthesis following resistance exercise. Acta Physiol Scand 182: 189–196, 2004.
Ventadour S, Attaix D. Mechanisms of skeletal muscle atrophy. Curr Opin Rheumatol 18: 631–635,2006.
Vincent MA, Clerk LH, Lindner JR, Price WJ, Jahn LA, Leong-Poi H, Barrett EJ. Mixed meal and light exercise each recruit muscle capillaries in healthy humans. Am J Physiol Endocrinol Metab 290:E1191–E1197, 2006.
Volpi E, Mittendorfer B, Rasmussen BB, Wolfe RR. The response of muscle protein anabolism to combined hyperaminoacidemia and glucose-induced hyperinsulinemia is impaired in the elderly. J Clin Endocrinol Metab 85: 4481–4490, 2000.
Wackerhage H, Ratkevicius A. Signal transduction pathways that regulate muscle growth. Essays biochem 44: 99–108, 2008.
Wang N, Hikida RS, Staron RS, Simoneau JA. Muscle fiber types of women after resistance training–quantitative ultrastructure and enzyme activity. Pflügers Arch 424: 494–502, 1993.
Welle S, Bhatt K, Thornton CA. Stimulation of myofibrillar synthesis by exercise is mediated by more efficient translation of mRNA. J Appl Physiol 86: 1220–1225, 1999.
Westh E, Kongsgaard M, Bojsen-Moller J, Aagaard P, Hansen M, Kjaer M, Magnusson SP.Effect of habitual exercise on the structural and mechanical properties of human tendon, in vivo, in men and women. Scand J Med Sci Sports 18: 23–30, 2008.
Wilkinson SB, Phillips SM, Atherton PJ, Patel R, Yarasheski KE, Tarnopolsky MA, Rennie MJ. Differential effects of resistance and endurance exercise in the fed state on signalling molecule phosphorylation and protein synthesis in human muscle. J Physiol 586: 3701–3717, 2008.
Wilkinson SB, Tarnopolsky MA, MacDonald MJ, Macdonald JR, Armstrong D, Phillips SM.Consumption of fluid skim milk promotes greater muscle protein accretion following resistance exercise than an isonitrogenous and isoenergetic soy protein beverage. Am J Clin Nutr 85: 1031–1040, 2007.
Williamson D, Gallagher P, Harber M, Hollon C, Trappe S. Mitogen-activated protein kinase (MAPK) pathway activation: effects of age and acute exercise on human skeletal muscle. J Physiol 547:977–987, 2003.
Zhang SJ, Truskey G, Kraus WE. Effect of cyclic stretch on β1D integrin expression and activation of FAK and RhoA. Am J Physiol Cell Physiol 292: C2057–C2069, 2007.