
El movimiento es una propiedad fundamental en el desarrollo del organismo humano y se realiza mediante la acción de los músculos sobre los huesos después de que el sistema nervioso guía su acción y mientras que los sistemas respiratorio, cardiocirculatorio y sanguíneo transportan a los tejidos el oxígeno y las metabolitos nutritivos [1]. El músculo es el mayor promotor bioquímico que convierte la energía potencial (química) en energía cinética (mecánica), además es el tejido que más se extiende a lo largo del cuerpo y que proporciona un poco menos del 25% de la masa corporal al nacer y más del 30-40% en el hombre adulto [2].
Cuando una miofibrilla es examinada por microscopía electrónica, se pueden observar bandas alternadas oscuras (anisotrópicas, desvían la luz polarizada) y claras (isotrópicas, que no alteran la luz polarizada). Estas bandas son conocidas como las bandas A e I respectivamente. La región central de la banda A es la banda H, la cual aparece menos densa que el resto de las bandas mientras que la banda I está dividida por una línea densa y delgada conocida como línea o disco Z (Figura 1). De esta manera, el sarcómero es definido como la región entre dos líneas Z y se repite a lo largo del eje de la fibra a distancias de 1500-2300 nm dependiendo del estado de contracción [2].
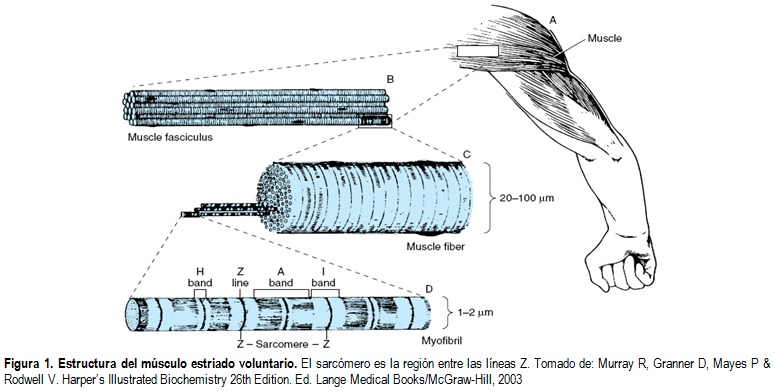
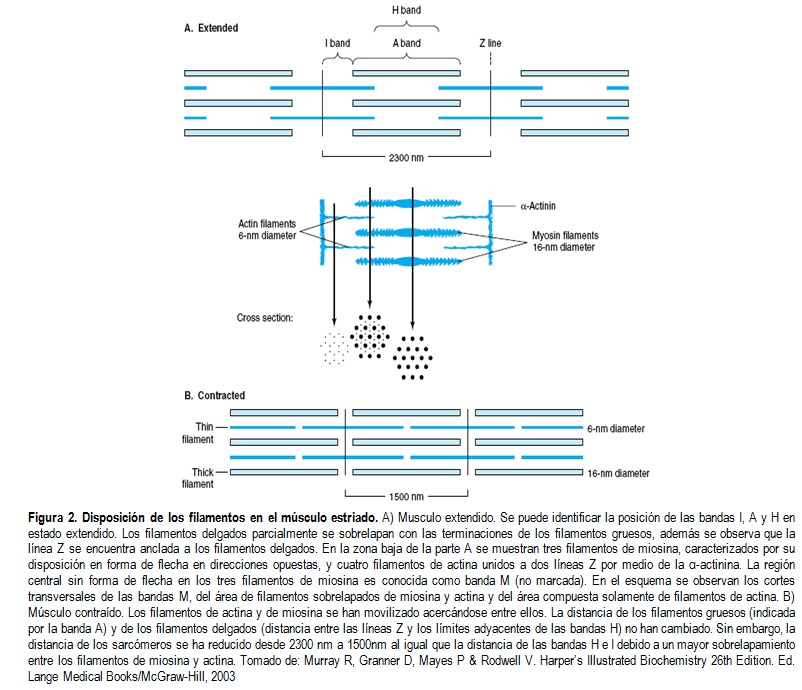
Las miofibrillas se encuentran constituidas por dos filamentos longitudinales. Un tipo es el filamento grueso confinado en la banda A que contiene principalmente miosina. Estos filamentos tienen cerca de 16 nm de diámetro y se encuentran dispuestos en forma hexagonal desde la perspectiva de corte transversal de la fibra. El filamento delgado (cerca de 7 nm de diámetro) se encuentra en la banda I y se extiende al interior de la banda A aunque no adentro de la banda H (Figura 2). Los filamentos delgados contienen las proteínas actina, tropomiosina y troponina. En la banda A, los filamentos delgados están dispuestos alrededor de los filamentos de miosina como un hexágono secundario, es decir que cada filamento delgado es encuentra sistemáticamente entre tres filamentos gruesos y a su vez cada filamento grueso está rodeado simétricamente por seis filamentos delgados [2].
La masa del músculo esquelético está compuesta casi el 75% por agua y un poco más del 20% por proteína, principalmente miosina y actina. La miosina constituye una familia de proteínas con por lo menos 15 isoformas identificadas; sin embargo, en este documento se hará referencia a la miosina II por su relación directa con el entrenamiento de resistencia. La miosina es un hexámero asimétrico con una masa molecular de 460 kDa que contribuye con un 55% al peso de la proteína muscular y que está compuesta por un extremo fibroso de dos hélices intercaladas, cada hélice tiene una cabeza globular ligada a cada extremo. El hexámero consiste de una par de cadenas pesadas (MHC, myosin heavy-chain, aprox. 200 kDa c/u) y dos cadenas ligeras (aprox. 20 kDa c/u), de las cuales se diferencian dos tipos una llamada cadena ligera esencial y la otra cadena ligera regulatoria. Por otro lado, la actina-G monomérica (43 kDa; G, globular) compone el 25% de la proteína muscular. En condiciones iónicas fisiológicas y en la presencia de Mg2+, la actina-G se polimeriza de forma no covalente para formar un filamento doble helicoidal insoluble denominado actina-F (F, filamentosa) de unos 6-7 nm de diámetro y con una estructura repetitiva cada 35.5 nm. En el músculo estriado hay otras dos proteínas que son menores en tamaño pero importantes en función y que acompañan a la actina en la composición de los filamentos delgados, son la tropomiosina y el complejo de troponina. La tropomiosina es una molécula fibrosa presente en todas las estructuras musculares que consiste de dos cadenas, α y β, que se unen a la actina-F entre las ranuras de sus filamentos. El complejo de troponina es único del músculo estriado y consiste de tres polipéptidos unidos entre sí: La troponina T (TpT) con gran afinidad por la tropomiosina; la troponina I (TpI) con gran afinidad por la actina y que de este modo inhibe la interacción actina F-miosina; y la troponina C (TpC) que es un polipéptido ligado al calcio que es estructural y funcionalmente análogo a la calmodulina (cuatro moléculas del ión Ca2+ se unen a una molécula de TpC o de calmodulina, ambas proteínas con una masa molecular de 17 kDa) [2].
Además de las proteínas anteriormente mencionadas, el músculo esquelético también consta de tinina, también conocida como conectina, una enorme molécula elástica (es la proteína más grande que se conoce, 3000 kDa) que tiene más de 25000 aminoácidos y se extiende desde una línea Z hasta la línea M. Esta proteína tiene varias funciones: estabilizar la posición de los elementos contráctiles y gracias a su elasticidad, recuperar la longitud de los músculos durante la relajación o la posición de reposo; además, contribuye de forma importante a la generación de la tensión pasiva del músculo. Solo el segmento de tinina confinado a la banda I es funcionalmente elástico, ya que esta banda juega un papel importante en la elasticidad muscular. El modelo actual para explicar la elasticidad muscular implica diferentes mecanismos que dependen de la fuerza generada. Por otra parte, la tinina es ayudada por la nebulina, una proteína no elástica de 600 a 900 kDa que discurre conjuntamente al filamento fino y se inserta en la línea Z. La nebulina contribuye a la alineación de los filamentos delgados del sarcómero regulando así su ensamblaje [3]. El miocito también cuenta con algunas proteínas citoesqueléticas como la espectina, la vinculina y la talina, las cuales forman una rejilla bidimensional al lado citoplasmático del sarcolema o membrana plasmática muscular. Las conexiones transversales de esta rejilla son llamadas costámeros y se encuentran entre las miofibrillas y el sarcolema, generalmente al nivel de la línea Z. Filamentos intermedios, compuestos principalmente de la proteína desmina, se acoplan desde la línea Z hasta los costámeros y de esta manera proveen un enlace entre la periferia de las líneas Z y el sarcolema, además de estar involucrados en la transmisión de la fuerza al interior del músculo. Por otro lado, la línea M contiene 4 proteínas que son la CK-MM, la proteína M, la miomesina y las esqueleminas, las cuales se ligan a los filamentos gruesos al interior de los arreglos hexagonales [36]. Otras proteínas estructurales del sarcómero son la α-actinina, ancla la actina a las líneas Z, y la distrofina, enlazada al sarcolema [3].
REFERENCIAS
[1] Álvarez Velásquez IM, Álvarez Velásquez FF, Álvarez Barreras F & Mena R. (2006). El Proceso de Asimilación de la Fuerza en el Músculo del Ser Humano. Ra Ximhai 2 (002); 533-548
[2] Murray R, Granner D, Mayes P & Rodwell V. (2003). Harper’s Illustrated Biochemistry 26th Edition. Ed. Lange Medical Books/McGraw-Hill
[3] Chicharro J & Fernández A. (2006). Fisiología del Ejercicio. Madrid: Ed Médica Panamericana.



